Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

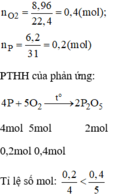
→ Oxi dư, vậy bài toán tính theo số mol của P
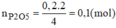
Do H = 80% nên khối lượng chất rắn thu được sau phản ứng là:
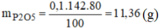

nP = 7,44/31 = 0,24 (mol)
nO2 = 6,16/22,4 = 0,275 (mol)
PTHH: 4P + 5O2 -> (t°) 2P2O5
LTL: 0,24/4 > 0,275/5 => P dư
nP2O5 = 0,275 : 5 . 2 = 0,11 (mol)
mP2O5 = 0,11 . 142 = 15,62 (g)
\(4P+5O_2->2P_2O_5\)
4 5 2
0,24 0,3 0,12 (mol)
\(n_P=\dfrac{m}{M}=\dfrac{7,44}{31}=0,24\left(mol\right)\)
\(m_{P_2O_5}=n\text{×}M=0,12\text{×}\left(31\text{×}2+16\text{×}5\right)=0,12\text{×}142=17,04\left(g\right)\)

$a) 4P + 5O_2 \xrightarrow{t^o} 2P_2O_5$
$n_P = \dfrac{6,2}{31} = 0,2(mol) ; n_{O_2} = \dfrac{7,84}{22,4} = 0,35(mol)$
$n_P : 4 = 0,05 < n_{O_2} :5 = 0,07$ nên $O_2$ dư
$n_{O_2\ pư} = \dfrac{5}{4}n_P = 0,25(mol)$
$\Rightarrow m_{O_2\ dư} = (0,35 - 0,25).32 = 3,2(gam)$
c) $n_{P_2O_5} = \dfrac{1}{2}n_P = 0,1(mol)$
$m_{P_2O_5} = 0,1.142 = 14,2(gam)$
\(n_P=\dfrac{6,2}{31}=0,2\left(mol\right)\\ n_{O_2}=\dfrac{7,84}{22,4}=0,35\left(mol\right)\\a, 4P+5O_2\rightarrow\left(t^o\right)2P_2O_5\\ V\text{ì}:\dfrac{0,35}{5}>\dfrac{0,2}{4}\Rightarrow O_2d\text{ư}\\ n_{O_2\left(d\text{ư}\right)}=0,35-\dfrac{5}{4}.0,2=0,1\left(mol\right)\\b, m_{O_2\left(d\text{ư}\right)}=0,1.32=3,2\left(g\right)\\ c,n_{P_2O_5}=\dfrac{n_P}{2}=\dfrac{0,2}{2}=0,1\left(mol\right)\\ m_{r\text{ắn}}=m_{P_2O_5}=142.0,1=14,2\left(g\right)\)

a, \(4P+5O_2\underrightarrow{t^o}2P_2O_5\)
b, \(n_P=\dfrac{6,2}{31}=0,2\left(mol\right)\)
\(n_{O_2}=\dfrac{8,96}{22,4}=0,4\left(mol\right)\)
Xét tỉ lệ: \(\dfrac{0,2}{4}< \dfrac{0,4}{5}\), ta được O2 dư.
Theo PT: \(n_{O_2\left(pư\right)}=\dfrac{5}{4}n_P=0,25\left(mol\right)\Rightarrow n_{O_2\left(dư\right)}=0,4-0,25=0,15\left(mol\right)\)
\(\Rightarrow m_{O_2\left(dư\right)}=0,15.32=4,8\left(g\right)\)
c, Theo PT: \(n_{P_2O_5}=\dfrac{1}{2}n_P=0,1\left(mol\right)\Rightarrow m_{P_2O_5}=0,1.142=14,2\left(g\right)\)
d, \(m_{P_2O_5}=14,2.80\%=11,36\left(g\right)\)

\(n_P=\dfrac{3,1}{31}=0,1\left(mol\right)\\
n_{O_2}=\dfrac{3,2}{32}=0,1\left(mol\right)\\
pthh:4P+5O_2\underrightarrow{t^o}2P_2O_5\\
LTL:\dfrac{0,1}{4}>\dfrac{0,1}{5}\)
P dư
\(n_{P\left(p\text{ư}\right)}=\dfrac{4}{5}n_{O_2}=0,08\left(mol\right)\\
m_{P\left(d\right)}=0,08.31=0,62\left(g\right)\\
n_{P_2O_5}=\dfrac{2}{5}n_{O_2}=0,04\left(mol\right)\\
m_{P_2O_5}=0,04.142=5,68\left(g\right)\\
m_{sp}=0,62+5,68=6,3\left(g\right)\)
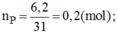
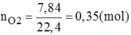
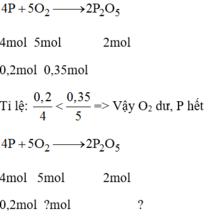
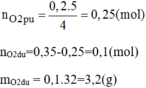
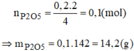
4P+5O2(to)---> 2P2O5
nP=1,55/31=0,05(mol)
nO2=1,344 : 22,4 = 0,06(mol)
Xét tỉ lệ 0,05 : 4 > 0,06 :5
=> nP2O5 = 2/5 . 0,06 = 0,024 mol
=> mP2O5 = 0,024 . 142 = 3,408 g