Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Tính nồng độ phần trăm của dung dịch trong các trường hợp sau:
a) Cho 20 gam NaCl tan hoàn toàn trong 80 gam H2O?
-> mddNaCl= mNaCl+mH2O= 20+80=100(g)
=>C%ddNaCl= (mNaCl/mddNaCl).100%= (20/100).100= 20%
b) Cho 50 gam H2O vào 100 gam dung dịch HCl 10%?
mHCl= 10%.100= 10(g)
=> mddHCl(sau)= mddHCl(10%)+mH2O= 100+50=150(g)
=>C%ddHCl(sau)= (mHCl/mddHCl(sau)).100%= (10/150).100\(\approx6,667\%\)
c) Trộn 200 gam dung dịch HCl 20% với 100 gam dung dịch HCl 10%?
--
mHCl(tổng)= 200.20%+100.10%= 50(g)
mddHCl(tổng)=200+100=300(g)
=> C%ddHCl(tổng)= (mHCl(tổng)/ mddHCl(tổng)).100%= (50/300).100\(\approx16,667\%\)
d) Cho thêm 10 gam NaCl vào 90 gam dung dịch NaCl 30%?
---
mNaCl(trong dd 30%)= 30%.90=27(g)
=>mNaCl(tổng)= 10+27=37(g)
mddNaCl(tổng)=10+90=100(g)
=>C%ddNaCl(sau)= (mNaCl(tổng)/ mddNaCl(tổng)).100%= (37.100)/100= 37%

Câu 9:
a) PTHH: \(Zn+H_2SO_4-->ZnSO_4+H_2\uparrow\)
\(n_{Zn}=\dfrac{9,75}{65}=0,15\left(mol\right)\)
\(n_{H_2SO_4}=\dfrac{15,68}{98}=0,16\left(mol\right)\)
Ta có tỉ lệ: \(\dfrac{0,15}{1}< \dfrac{0,16}{1}\) => \(H_2SO_4\) dư
Theo PTHH \(n_{H_2SO_4}=n_{Zn}=0,15\left(mol\right)\)
=> \(m_{H_2SO_4\left(dư\right)}=\left(0,16-0,15\right)98=0,98\left(g\right)\)
b) Theo PTHH: \(n_{H_2}=n_{Zn}=0,15\left(mol\right)\)
=> \(V_{H_2}=0,15.22,4=3,36\left(l\right)\)

Bài 2
Ta có:
nFe=0,2 mol nHCl=0,6 mol
Fe+2HCl=FeCl2+H2
0,2->0,4--->0,2
suy ra sau phản ứng có: 0,2molFeCl2 và 0,2mol HCl dư
CM muối=0,2/0,2=1M
CM axit dư=0,2/0,2=1M

a) PTHH: Fe + H2SO4 \(\rightarrow\) FeSO4 + H2\(\uparrow\)
Thep pt: 1mol....1mol........1mol......1mol
Theo đề: 0,2mol...0,2mol......0,2mol....0,2mol
b) nFe = \(\dfrac{m}{M}=\dfrac{11,2}{56}=0,2\left(mol\right)\)
\(\Rightarrow\)mFeSO4 = n.M = 0,2.152 = 30,4 (g)
c) mH2SO4 = n.M = 0,2.98 = 19,6 (g)
\(\Rightarrow\)C%ddH2SO4(l) = \(\dfrac{19,6}{100}.100\%=19,6\%\)
d) VH2(đktc) = n.22,4 = 0,2.22,4 = 4,48 (l)
e) mH2 = n.M = 0,2.2 = 0,4 (g)
mddspứ = mFe + mddH2SO4 + mH2 = 11,2 + 100 + 0,4 = 111,6 (g)
\(\Rightarrow\)Dung dịch sau phản ứng chỉ gồm FeSO4
\(\Rightarrow\)C% = \(\dfrac{30,4}{111,6}.100\%=27,24\%\)

nFeCl3.6H2O = 0,1 mol
=> nFeCl3 = nFeCl3.6H2O = 0,1 mol
mNaOH = 20 (g)
=> nNaOH = 0,5 mol
Pt: FeCl3 + 3NaOH --> 3NaCl + Fe(OH)3
.....0,1--------> 0,3-----> 0,3-------> 0,1
Xét tỉ lệ mol giữa FeCl3 và NaOH:
\(\dfrac{0,1}{1}< \dfrac{0,5}{3}\)
Vậy NaOH dư
mFe(OH)3 = 0,1 . 107 = 10,7 (g)
mdd sau pứ = mtinh thể + mdd NaOH - mkt
....................= 27,05 + 100 - 10,7 = 116,35 (g)
C% dd NaCl = \(\dfrac{0,3\times58,5}{116,35}.100\%=15,1\%\)
C% dd NaOH dư = \(\dfrac{\left(0,5-0,3\right).40}{116,35}.100\%=6,876\%\)
a) \(n_{FeCl_3.6H_2O}=n_{FeCl_3}=0,1\left(mol\right)\)
\(n_{NaOH}=\dfrac{100.20}{100.40}=0,5\left(mol\right)\)
PTHH:
FeCl3 + 3NaOH \(\rightarrow\) Fe(OH)3 + 3NaCl (1)
(mol) 0,1..........0,3.................0,1.................0,3
*Tỉ lệ mol:
\(n_{FeCl_3}\) : \(n_{NaOH}=\dfrac{0,1}{1}< \dfrac{0,5}{3}\)
\(\Rightarrow NaOH\) dư
(1) \(\rightarrow\) \(n_{Fe\left(OH\right)_3}=0,1\left(mol\right)\)
\(m_{Fe\left(OH\right)_3}=0,1.107=10,7\left(g\right)\)
b) \(m_{ddX}=m_{FeCl_3.6H_2O}+m_{ddNaOH}-m_{Fe\left(OH\right)_3}\)
\(=27,05+100-10,7\)
\(=116,35\left(g\right)\)
\(C\%_{NaCl/ddX}=\dfrac{0,3.58,5}{116,35}.100=15,08\%\)
\(C\%_{NaOHdư/ddX}=\dfrac{\left(0,5-0,3\right).40}{116,35}.100=6,88\%\)

1.
Khối lượng giảm là khối lượng H2O hoá hơi rồi bay đi: 25-16=9g
\(\rightarrow\)nH2O=\(\frac{9}{18}\)=0,5 mol
nCuSO4=\(\frac{16}{160}\)=0,1 mol
nCuSO4:nH2O=1:5
\(\rightarrow\) x=5, muối ngậm nước là CuSO4.5H2O
2.
\(\text{mdd = 1,2. 500 = 600 g}\)
\(\text{20: 100 = (mNaOH : 600)}\)\(\rightarrow\) mNaOH = 120 g \(\rightarrow\) nNaOH = 3 mol
Công thức tổng quát : Số mol chất tan \(\text{A = (C%. D. V): (100M) }\)với M là phân tử khối của chất tan A
3.
a, Giả sử có 184g dd H2SO4 98%\(\rightarrow\) mH2SO4=180,32g
\(\rightarrow\)nH2SO4= \(\frac{180,98}{98}\)=1,84 mol
V H2SO4=\(\frac{184}{1,84}\)=100ml=0,1l
\(\rightarrow\) CM=\(\frac{1,84}{0,1}\)=18,4M
b,
C%= \(\frac{\text{m ct. 100}}{\text{ m dd}}\)
d= \(\frac{\text{m ct}}{\text{V dd}}\)
CM=\(\frac{\text{n ct}}{\text{V dd}}\)
\(\rightarrow\)C%=\(\frac{\text{d. V dd . 100}}{\text{m dd}}\)
\(\Leftrightarrow\) C%=\(\frac{\text{d. n ct. 100}}{\text{CM. m dd}}\)
4.
Ban đầu:
\(\text{mddH2SO4 = 100 . 1,137 = 113,7}\)
nH2SO4 = \(\frac{\text{113,7 . 20%}}{98}\) = 0,232 mol
nBaCl2 = \(\frac{\text{400 . 5,29%}}{208}\) = 0,1 mol
PTHH: H2SO4 + BaCl2 —> BaSO4 + 2HCI
Bđ:_____ 0,232____0,1__________________(mol)
Pứ: ______0,1_____0, 1______0,1____0,2___(mol)
Sau pứ:____0,132____0___________________(mol)
\(\text{mBaSO4 = 0,1.233 = 23,3 gam}\)
Khối lượng dung dịch sau khi lọc bỏ kết tủa:
mddB = mddH2SO4 + mddBaCl2 - mBaSO4 = 490,4
C%HCI = \(\frac{\text{0,2.36,5}}{490,4}\) = 1,49%
C%H2SO4 dư = \(\frac{\text{0,132.98}}{490,4}\)= 2,64%

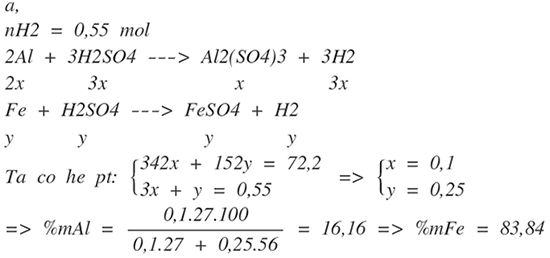
Câu b
Số mol của H2SO4 = 0,1.3 + 0,25 = 0,55
=> CM =\(\dfrac{\text{ 0,55}}{0,25}\) = 2,2
khối lượng Fe có trong hỗn hợp đầu là:
\(mFe=\dfrac{mh^2.\%mFe}{100\%}=\dfrac{60,5.46,289\%}{100\%}=28\left(g\right)\)
Số mol của kim loại Fe có trong hh
\(nFe=\dfrac{m}{M}=\dfrac{28}{56}=0,5\left(mol\right)\)
Khối lượng Zn có trong hh là:
\(mZn=mh^2-mFe=60,5-28=32,5\left(g\right)\)
số mol Zn là:
\(nZn=\dfrac{m}{M}=\dfrac{32,5}{65}=0,5\)(mol)
Ptr 1:\(Fe+2HCl\rightarrow FeCl_2+H_2\uparrow\)
.........1..........2..............1...........1
........0,5........1..............0,5........0,5
Ptr 2:\(Zn+2HCl\rightarrow ZnCl_2+H_2\uparrow\)
.........1..........2................1...........1
........0,5........1...............0,5........0,5
a.
m HCl=n.M = (0,5+0,5).36,5=36,5(g)
Nồng độ phần trăm chất tan của dd HCl là:
\(C\%=\dfrac{mct}{mdd}.100\%=\dfrac{36,5}{200}100\%=18,25\%\)
Thể tích H2 thu được là:
\(VH_2=n.22,4=\left(0,5+0,5\right).22,4=22,4\left(g\right)\)
b.
\(mFeCl_2=n.M=0,5\cdot127=63,5\left(g\right)\)
\(mZnCl_2=n.M=0,5\cdot136=68\left(g\right)\)
\(mH_2=n.M=1\cdot2=2\left(g\right)\)
Khối lượng dd thu được sau phản ứng là:
\(mdd=mh^2+mHCl-mH_2=60,5+200-2=258,2\left(g\right)\)
Nồng độ phần trăm FeCl2 có trong dd thu được là:
\(C\%=\dfrac{mFeCl_2}{mdd}.100\%=\dfrac{63,5}{258,5}=24,56\%\)
Nồng độ phần trăm ZnCl2 có trong dd thhu được là:\(C\%=\dfrac{mZnCl_2}{mdd}.100\%=\dfrac{68}{258,5}.100\%=26,31\%\)

Câu 1 : Sản phẩm của phản ứng giữa CaO với nước dư làm cho quỳ tím chuyển xanh :
A. Xanh B. Đỏ C. Tím D. Mất màu
Câu 2 : Cặp chất nào sau đây có thể phản ứng được với nhau :
A. H22 và Fe B. H22 và CaO C. H22 và HCl D. H22 và O22
Câu 3 : Cho các kim loại Na , Fe , Al có cùng số mol tác dụng lần lượt với dung dịch axit HCl . Kim loại khi phản ứng với dung dịch HCl cho nhiều thể tích khí hidro hơn là :
A. Al B. Fe C. Na D. Na và Fe
Câu 4 : Chất nào hòa tan trong nước tạo dung dịch bazo nhưng không tạo khí là :
A. CaO B. Na C. P22O55 D. CuO
Câu 5 : Có 3 axit sau : MgO , P22O55 , K22O . Có thể nhận biết các chất đó bằng thuốc khử nào sau đây
A. Chỉ dùng nước B. Dùng nước và giấy phenolphtalein không màu
C. Dùng nước và giấy quỳ tím D. B hoặc C đều được

Đáp án A