Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Chọn đáp án C
Các chất tham gia cho biết số lượng → cần lập tỉ lệ để xác định phần đủ hay dư.
Quan sát tỉ lệ và tương quan lượng electron cho nhận 2 bên → kim loại hết, cả H+ và H + đều dư.
xác định số mol NaOH → nhớ ngay đến ý tưởng “natri đi về đâu?”
X mol Na trong NaOH thêm vào và sẵn có 0,08 mol Na đến cuối cùng sẽ đi về đâu?
→ cần tìm số mol các anion (địa chỉ của Na đi về) trong dung dịch sau phản ứng.
Xem nào, là 0,2 mol S O 4 2 - và 0,04 mol NO3- x + 0,08 = 0,2 x 2 + 0,04 → x = 0,36
Theo đó, tương ứng giá trị của V là 360 ml

Đáp án C
Bản chất phản ứng của Fe, Cu với dung dịch hỗn hợp H2SO4, NaNO3 là phản ứng oxi hóa – khử. Xét toàn bộ quá trình phản ứng, ta thấy dung dịch cuối cùng chỉ chứa Na+, SO 4 2 - và NO 3 - .
Dựa vào giả thiết và áp dụng bảo toàn electron, bảo toàn điện tích cho dung dịch sau cùng, ta có :
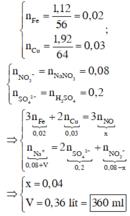

Đáp án C
Ta có ![]()
![]()
![]()
![]()
![]()
kim loại phản ứng hết
Dung dịch X chứa
H
+
: ![]()
![]()
Để lượng kết tủa lớn nhất gồm ![]()
![]()
![]()

Giải thích:
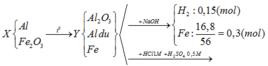
BT e: nAl dư = 2/3 nH2 = 2/3. 0,15 = 0,1 (mol)
BTNT: Fe => nFe2O3 = ½ nFe = 0,15 (mol)
Phản ứng xảy ra hoàn toàn, Al dư sau phản ứng ( vì Y + NaOH có khí H2 bay ra), do đó Fe2O3 phản ứng hết
Fe2O3 + 2Al Al2O3 + 2Fe
0,15 → 0,3
=> nAl ban đầu = 0,3 + 0,1 = 0,4 (mol)
nHCl = V (mol) ; nH2SO4 = 0,5V (mol)
Bảo toàn điện tích khi cho Y tác dụng với hh axit
=> 2nFe2+ + 3nAl3+ = nCl- + 2nSO42-
=> 2.0,3 + 3. 0,4 = V + 2. 0,5V
=> V = 0,9 (lít)
Đáp án B



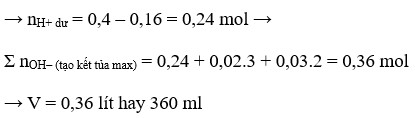
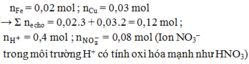
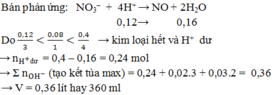
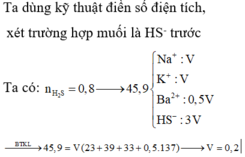
Đáp án A
Cho HCl 0,5M và H2SO4 0,25M vào 0,5 mol NaAlO2 và 0,5 mol NaOH thu được dung dịch X và 0,2 mol kết tủa Al(OH)3
Để cho lượng axit lớn nhất thì axit phải tham gia trung hòa hết NaOH, tạo kết tủa tới tối đa rồi sau đó hòa tan kết tủa tới khi còn 0,2 mol
→ V = 1 , 9