Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

số mol NaOH là:\(n_{NaOH}=\frac{10}{23+16+1}=0,25\left(mol\right)\)
PTHH\(3NaOH+FeCl_3\rightarrow Fe\left(OH\right)_3+3NaCl\)
\(m_{FeCl_3}=n.M=\frac{0.25}{3}\cdot\left(56+35,5\cdot3\right)\approx13,54\left(g\right)\)
\(m_{Fe\left(OH\right)_3}=n.M=\frac{0.25}{3}\cdot\left(56+\left(16+1\right)\cdot3\right)\approx8,91\left(g\right)\)
\(m_{NaCl}=n.M=0.25\cdot\left(23+35.5\right)=14.625\left(g\right)\)

Bảo toàn KL: \(m_{FeCl_3}+m_{KOH}=m_{Fe\left(OH\right)_3}+m_{KCl}\)
\(\Rightarrow m_{FeCl_3}=7+8,25-5,5=9,75\left(g\right)\)
Chọn D

a) PTHH: FeCl3 + 3KOH → Fe(OH)3 + 3KCl
b) Theo ĐLBTKL ta có:
\(m_{FeCl_3}+m_{KOH}=m_{Fe\left(OH\right)_3}+m_{KCl}\)
\(\Leftrightarrow m_{FeCl_3}=m_{Fe\left(OH\right)_3}+m_{KCl}-m_{KOH}=2,14+4,47-3,36=3,25\left(g\right)\)

\(n_{Fe}=\dfrac{5.6}{56}=0.1\left(mol\right)\)
\(Fe+\dfrac{3}{2}Cl_2\underrightarrow{^{^{t^0}}}FeCl_3\)
\(0.1.......0.15..........0.1\)
\(V_{Cl_2}=0.15\cdot22.4=3.36\left(l\right)\)
\(m_{FeCl_3}=0.1\cdot162.5=16.25\left(g\right)\)

a) 2Fe + 3Cl2 -----> 2FeCl3
b) 9NaOH + 3FeCl3 ------> 3Fe(OH)3 + 9 NaCl
c) 6KOH + Al2(SO4)3------>2Al(OH)3 + 3K2SO4
a) Tỉ lệ số nguyên tử Fe : tỉ lệ số phân tử Cl2 : tỉ lệ số phân tử FeCl3 la:2:3:2
b) Tỉ lệ số phân tử NaOH : tỉ lệ số phân tử FeCl3 : tỉ lệ số phân tử Fe(OH)3 : tỉ lệ số phân tử NaCl là:9:3:3:9
c) Tỉ lệ số phân tử KOH : tỉ lệ số phân tử Al(SO4)3 : tỉ lệ số phân tử Al(OH)3 : tỉ lệ số phân tử K2SO4 la: 6:1:2:3

a) nNaOH= 6/40=0,15(mol)
nFeCl3=32,5/162,5= 0,2(mol)
PTHH: 3 NaOH + FeCl3 -> Fe(OH)3 + 3 NaCl
0,15________0,05____0,05________0,15(mol)
Ta có: 0,2/1 > 0,15/3
=> NaOH hết, FeCl3 dư
=> nFeCl3(dư)= 0,2-0,05=0,15(mol)
=> mFeCl3= 162,5.0,15=24,375(g)
b)m(kết tủa)= mFe(OH)3= 0,05.107= 5,35(g)

a)
$Fe + 2HCl \to FeCl_2 + H_2$
$n_{Fe} = n_{H_2} = \dfrac{3,36}{22,4} = 0,15(mol)$
$m_{Fe} = 0,15.56 = 8,4(gam)$
b) $n_{HCl} = 2n_{H_2} = 0,3(mol)$
$\Rightarrow m_{HCl} = 0,3.36,5 = 10,95(gam)$
c)
Cách 1 : $n_{FeCl_2} = n_{H_2} = 0,15(mol) \Rightarrow m_{FeCl_2} = 0,15.127 = 19,05(gam)$
Cách 2 : Bảo toàn khối lượng, $m_{FeCl_2} = 8,4 + 10,95 - 0,15.2 = 19,05(gam)$
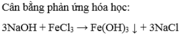
PTHH: \(3NaOH+FeCl_3\rightarrow3NaCl+Fe\left(OH\right)_3\downarrow\)
Ta có: \(n_{NaOH}=\dfrac{10}{40}=0,25\left(mol\right)\)
\(\Rightarrow n_{FeCl_3}=n_{Fe\left(OH\right)_3}=\dfrac{1}{12}\left(mol\right)\) \(\Rightarrow\left\{{}\begin{matrix}m_{FeCl_3}=\dfrac{1}{12}\cdot162,5\approx13,54\left(g\right)\\m_{Fe\left(OH\right)_3}=\dfrac{1}{12}\cdot107\approx8,92\left(g\right)\end{matrix}\right.\)
nNaOH = m/M = 10/(23 +16 + 1) = 0,25 (mol)
Ta có PTHH: 3NaOH + FeCl3 ------> Fe(OH)3 + 3NaCl
Theo PT: 3 - 1 - 1 (mol)
BC: 0.25 - 0.083 - 0.083 (mol)
Suy ra: mFeCl3 = n x M = 0.083 x (56 + 35,5 x 3) = 13,4875 (g)
mFe(OH)3 = n x M = 0,083 x (56+17 x 3) = 8,881 (g)