
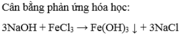
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

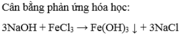

\(2KClO_3\underrightarrow{t^o}2KCl+3O_2\\ 5O_2+4P\underrightarrow{t^o}2P_2O_5\\ P_2O_5+3H_2O\rightarrow2H_3PO_4\\ 3Zn+2H_3PO_4\rightarrow Zn_3\left(PO_4\right)_2+3H_2\\ 2H_2+O_2\underrightarrow{t^o}2H_2O\\ CaCO_3\underrightarrow{t^o}CO_2+CO_2\\ CaO+H_2O\rightarrow Ca\left(OH\right)_2\)

a, C + O2 -> CO2 (phản ứng hóa hợp)
b, 2KClO3 -> 2KCl + 3O2 (phản ứng phân hủy)
c, H2 + O2 -> H2O (phản ứng hóa hợp)
d, H2 + CuO -> Cu + H2O (phản ứng thế)
e, Fe + CuSO4 -> FeSO4 + Cu (phản ứng thế)
f, 2Al + 6HCl -> 2AlCl3 + 3H2 (phản ứng thế)

\(2KClO_3\rightarrow3O_2+2KCl\)
\(5O_2+4P\rightarrow2P_2O_5\)
\(P_2O_5+3H_2O\rightarrow2H_3PO_4\)
\(3Zn+2H_3PO_4\rightarrow Zn_3\left(PO_4\right)_2+3H_2\)
\(2H_2+O_2\rightarrow2H_2O\)
\(CaCO_3\rightarrow CO_2+CaO\)
\(CaO+H_2O\rightarrow Ca\left(OH\right)_2\)
lần sau đừng lấy C, K vì dễ lẫn vs cữ viết tắt của cacbon và kali

a. 2Al + 3Cl2 - - to-- > 2AlCl3
b.2 K +2 H 2 O - - -- >2 KOH + H 2
c. FeCl3 + 3NaOH --- > Fe(OH) 3 + 3NaCl
d. BaO + C O 2 - --- > BaC O 3
e. 2Cu(NO 3 ) 2 -- t ° - - > 2CuO + 4NO 2 + O 2
f. 2AgNO 3 -- t ° - - >2 Ag + 2NO 2 + O 2
g. 4Fe(NO 3 )3 - - t ° -- >2Fe 2 O 3 + 12NO2 + 3O 2
h. C 6 H 6 + 15/2O 2 - - t ° -- > 6CO 2 + 3
a,d là phản ứng hóa hợp

Hoàn thành các phương trình phản ứng hóa học sau và cho biết chúng thuộc loại phản ứng nào?
A) 4Na + O₂-to>2Na2O (hoá hợp)
B) S + O₂-to>SO2(hoá hợp)
C) H₂ + CuO-to>Cu+H2Ooxi hoá , khử )
D) 4H₂ + Fe₃O₄-to>3Fe+4H2Ooxi hoá , khử )
E)2 KClO₃-to>2KCl+3O2 (phân huỷ)
F) Fe +2 HCl->FeCl2+H2(oxi hoá , khử )
G) Zn + H₂SO₄->ZnSO4+H2(oxi hoá , khử )
H) H₂O + CO₂->H2CO3(hoá hợp)
I) 2H₂O + 2K->2KOH+H2 (oxi hoá , khử )
J) H₂O + CaO->Ca(OH)2(hoá hợp)

Câu 1 :
b)
Cho quỳ tím ẩm vào mẫu thử
- mẫu thử hóa đỏ là P2O5
P2O5 + 3H2O $\to$ 2H3PO4
- mẫu thử hóa xanh là Na2O,CaO
Na2O + H2O $\to $ 2NaOH
CaO + H2O $\to$ Ca(OH)2
- mẫu thử không đổi màu là NaCl
Cho hai mẫu thử còn vào dung dịch H2SO4
- mẫu thử tạo kết tủa trắng là CaO
CaO + H2SO4 $\to$ CaSO4 + H2O
- mẫu thử không hiện tượng là Na2O
Câu 2 :
1)
\(S_{Na_2SO_4} = \dfrac{m_{Na_2SO_4}}{m_{H_2O}}.100 = \dfrac{7,2}{80}.100\% = 9(gam)\\ C\%_{Na_2SO_4} = \dfrac{S}{S + 100}.100\% = \dfrac{9}{100 + 9}.100\% = 8,26\%\)

Câu 3: (2.0) Hoàn thành và phân loại các phương trình hóa học sau, ghi rõ điều
kiện phản ứng (nếu có).
a. 2C4H10 +13 O2 → 8CO2 + 10H2O
b. 2KMNO4 → K2MnO4 + MnO2 + O2
c. C3HS + O2 → ?
d. 2KCIO3 → 2KCl + 3O2
e. 2Mg + O2 → 2MgO
f. 4Al + 3O2 → 2Al2O3
g. 3Fe + 2O2 → Fe3O4
h. 4P +5O2 →2P2O5
i. C+O2→ CO2
j. 2Zn + O2→2 Zno
check lại phẩn c hộ mk

4Al + 3O2 \(\rightarrow\) 2Al2O3 ( Phản ứng hóa hợp )
2KNO3 \(\rightarrow\) 2KNO2 + O2 ( Phản ứng phân hủy )
4P + 5O2 \(\rightarrow\) 2P2O5 ( Phản ứng hóa hợp )
2C2H2 + 5O2 \(\rightarrow\) 4CO2 + 2H2O ( Pứ cháy )
2HgO \(\rightarrow\) 2Hg + O2 ( Phản ứng phân hủy )
\(4Al+3O_2\underrightarrow{t^o}2Al_2O_3\) (Phản ứng hóa hợp)
\(4P+5O_2\underrightarrow{t^o}2P_2O_5\) (Phản ứng hóa hợp)
\(2KNO_3\underrightarrow{t^o}2KNO_2+O_2\) (Phản ứng phân hủy)
\(2C_2H_2+5O_2\underrightarrow{t^o}4CO_2+2H_2O\) (Phản ứng cháy)
\(2HgO\underrightarrow{t^o}2Hg+O_2\) (Phản ứng phân hủy)

\(N_2O_5+H_2O\rightarrow2HNO_3\left(P.Ứ.hoá.hợp\right)\\ 2K+2H_2O\rightarrow2KOH+H_2\left(P.Ứ.thế\right)\\ CaO+H_2O\rightarrow Ca\left(OH\right)_2\left(P.Ứ.hoá.hợp\right)\\ SO_3+H_2O\rightarrow H_2SO_4\left(P.Ứ.hoá.hợp\right)\\ K_2O+H_2O\rightarrow2KOH\left(p.ứ.Hoá.hợp\right)\\ Ca+2H_2O\rightarrow Ca\left(OH\right)_2+H_2\left(P.Ứ.thế\right)\\ P_2O_5+3H_2O\rightarrow2H_3PO_4\left(P.ứ.hoá.hợp\right)\)