Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(SO_3+H_2O\rightarrow H_2SO_4\\ m_{H_2SO_4\left(tăng\right)}=\dfrac{98}{80}m=\dfrac{49}{40}m=1,225m\left(g\right)\\ m_{H_2SO_4\left(dd.14,7\%\right)}=14,7.200=29,4\left(g\right)\\ Ta.có:C\%_{ddH_2SO_4\left(cuối\right)}=20\%\\ \Leftrightarrow\dfrac{29,4+1,225m}{m+200}.100\%=20\%\\ m\approx10,3415\left(g\right)\)

mdung dịch H2SO4 = 500.1,2 =600(g)
=> mH2SO4 = 600.24,5% =147(g)
PTHH : SO3 + H2O -> H2SO4
nSO3 =\(\dfrac{m}{80}\) mol
Theo PTHH => nH2SO4 = m/80 (mol) => mH2SO4 = 1,225m(g)
=> 147 (g)
mdung dịch = m + 600 (g)
Theo bài ra ta có hệ :
\(\dfrac{1,225m+147}{m+600}\).100%=49%
=>m=200g

đặt số mol oleum là x => số mol H2SO4 là \(\dfrac{89}{49}\)x
khối lượng dd sau phản ứng là x *178 + 200
theo bài ta có (\(\dfrac{89}{49}\)x * 98)/(x*178+200)=0,2 => x=0,28 mol
=> m H2SO4.SO3=0,28*178=49,84 g
bạn ơii, cho mình hỏi là tại sao số mol H2SO4 là 89/49x ạ?


\(n_{SO_3}=\dfrac{200}{80}=2,5\left(mol\right)\)
mdd H2SO4 17% = 1000.1,12 = 1120 (g)
=> \(m_{H_2SO_4}=\dfrac{1120.17}{100}=190,4\left(g\right)\)
PTHH: SO3 + H2O --> H2SO4
2,5------------>2,5
=> mH2SO4(sau pư) = 2,5.98 + 190,4 = 435,4 (g)
mdd sau pư = 200 + 1120 = 1320 (g)
\(C\%_{dd.H_2SO_4.sau.pư}=\dfrac{435,4}{1320}.100\%=32,985\%\)

\(a)\ n_{Al} = \dfrac{8,1}{27} = 0,3(mol)\\ n_{H_2SO_4} = \dfrac{200.14,7\%}{98} = 0,3(mol)\\ 2Al + 3H_2SO_4 \to Al_2(SO_4)_3 + 3H_2\\ n_{H_2SO_4} = 0,3 < \dfrac{3}{2}n_{Al} = 0,45\)
Do đó, Al dư
\(n_{H_2} = n_{H_2SO_4} = 0,3(mol)\\ V = 0,3.22,4 = 6,72(lít)\)
b)
\(n_{Al\ pư} = \dfrac{2}{3}n_{H_2SO_4} = 0,2(mol)\\ n_{Al_2(SO_4)_3} = \dfrac{1}{3}n_{H_2SO_4} = 0,1(mol)\\ m_{dd} = 0,2.27 + 200 - 0,3.2 = 204,8(gam)\\ \Rightarrow C\%_{Al_2(SO_4)_3} =\dfrac{0,1.342}{204,8}.100\% = 16,7\%\)
pt: 2Al + 3H2SO4 \(\rightarrow\) Al2(SO4)3 +3H2
nAl =\(\dfrac{8,1}{27}=0,3\left(mol\right)\), \(m_{H_2SO_4}=14,7\%.200=29,4g\Rightarrow n_{H_2SO_4}=\dfrac{29,4}{98}=0,3mol\)
Theo pt: \(nAl:nH_2SO_4=\dfrac{0,3}{2}:\dfrac{0,3}{3}=0,15:0,1=3:2\)
=> Al dư
Theo pt: nH2 = nH2SO4 = 0,3mol => VH2 = 0,3.22,4=6,75 lít
b) theo pt: nAl2(SO4)3 = \(\dfrac{1}{3}nH_2SO_4=0,1mol\)
=> mAl2(SO4)3 = 0,1.342 = 34,2g
Áp dụng bảo toàn khối lượng
mAl + mH2SO4 = mAl2(SO4)3 dung dịch + mH2
=> m dung dịch Al2(SO4)3 = 8,1+200-0,3.2 = 207,5g
C% A = \(\dfrac{34,2}{207,5}.100\%\approx16,48\%\)

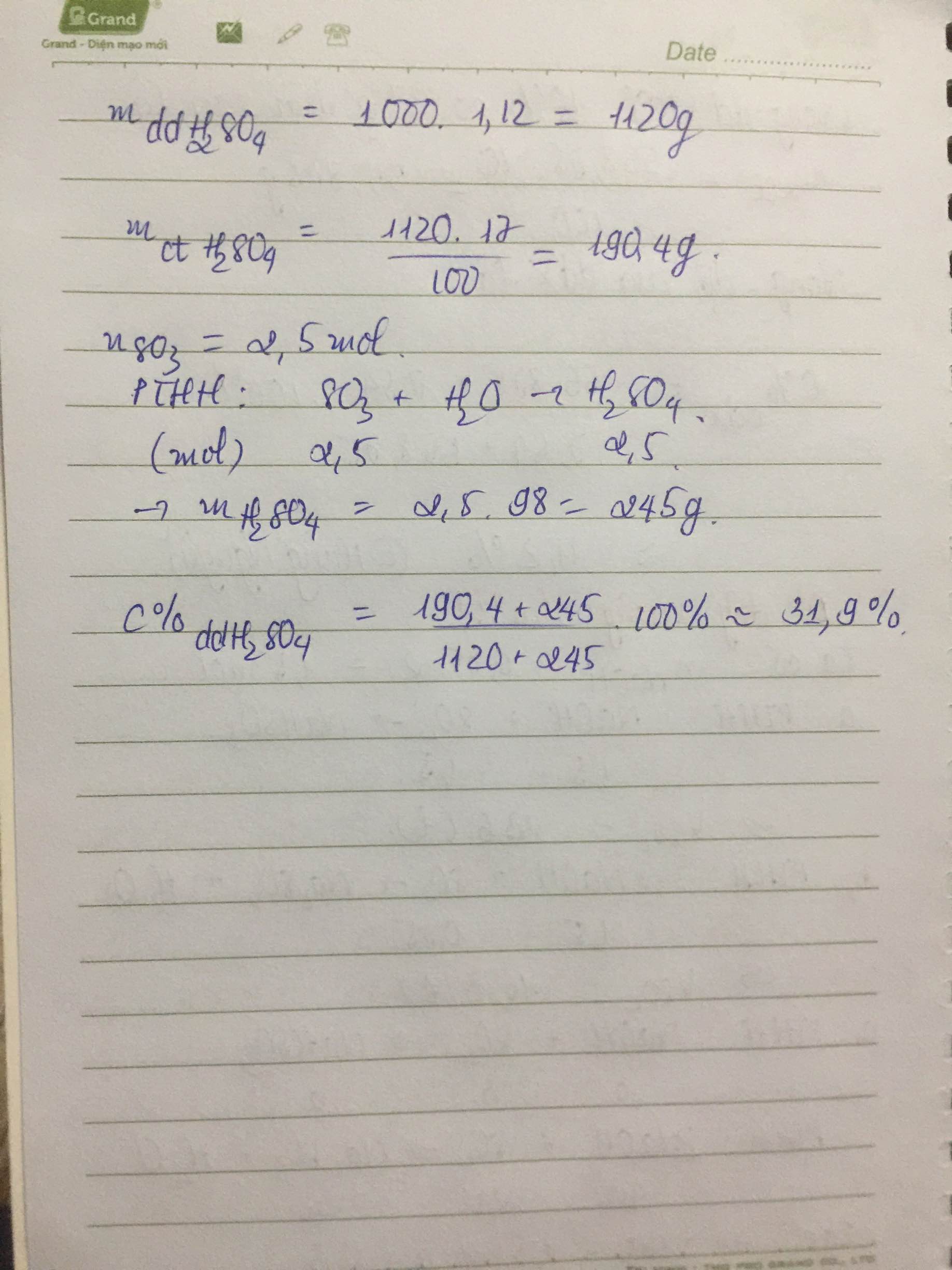
\(SO_3+H_2O\rightarrow H_2SO_4\\ n_{SO_3}=a\left(mol\right)\\ \rightarrow m_{SO_3}=80a\left(g\right);m_{H_2SO_4}=98a\left(g\right)\\ Vì:dd.thu.được.nồng.độ.20\%,nên.ta.có:\\ \dfrac{200.14,7\%+98a}{80a+200}.100\%=20\%\\ \Leftrightarrow a=12,927\\ Vậy:m=m_{SO_3}=12,927\left(g\right)\)