Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(n_{Na}=\dfrac{4.6}{23}=0.2\left(mol\right)\)
\(Na+H_2O\rightarrow NaOH+\dfrac{1}{2}H_2\)
\(0.2......................0.2.......0.1\)
\(V_{H_2}=0.1\cdot22.4=2.24\left(l\right)\)
Dung dịch X : NaOH
\(m_{dd_X}=4.6+200-0.1\cdot2=204.4\left(g\right)\)
\(C\%_{NaOH}=\dfrac{0.2\cdot40}{204.4}\cdot100\%=3.9\%\%\)

nCO2=0,4(mol)
a) PTHH: 2 NaOH + CO2 -> Na2CO3 + H2O
0,8_________0,4________0,4(mol)
=> mNaOH=0,8.40=32(g)
=>C%ddNaOH=(32/200).100=16%
b) mddNa2CO3=mddNaOH+mCO2=200+0,4.44=217,6(g)
mNa2CO3=106.0,4=42,4(g)
=>C%ddNa2CO3=(42,4/217,6).100=19,485%
Chúc em học tốt!
nCO2=8,96/22,4=0,4mol
a/ CO2+2NaOH→Na2CO3+H2O
0,4 0,8 0,4 0,4
mNaOH=0,8.40=32g
C%ddNaOH=mct/mdd.100%=32/200.100%=16%
b/mCO2=0,4.44=17,6g
Theo định luật bảo toàn khối lượng:
mCO2+mNaOH=mNa2CO3
17,6g+200g=217,6g
mNa2CO3=0,4.106=42,4g
C%ddNa2CO3=mct/mdd.100%=42,4/217,6.100=19,4852g

\(n_{MgCO_3}=\dfrac{16,8}{84}=0,2mol\\ a.MgCO_3+H_2SO_4->MgSO_4+H_2O+CO_2\\ 2NaOH+H_2SO_{\text{4 }}->Na_2SO_4+2H_2O\\ b.n_{H_2SO_4dư}=\dfrac{1}{2}n_{NaOH}=\dfrac{1}{2}.80.0,1:40=0,1mol\\ n_{H_2SO_4\left(MgCO_3\right)}=0,2mol\\ c.C\%=\dfrac{98.0,3}{200}.100\%=14,7\%\\ V=0,2.22,4=4,48L\\ d.m_{ddsau}=200+16,8-44.0,2+80=288g\\ C\%_{Na_2SO_4}=\dfrac{40.0,1}{288}.100\%=1,39\%\\ C\%_{MgSO_4}=\dfrac{120.0,2}{288}.100\%=8,33\%\)
\(n_{MgCO_3}=\dfrac{16,8}{84}=0,2\left(mol\right)\)
\(n_{NaOH}=\dfrac{80}{40}=2\left(mol\right)\)
PTHH :
\(MgCO_3+H_2SO_4\rightarrow MgSO_4+H_2O+CO_2\uparrow\)
0,2 0,2 0,2
\(2NaOH+H_2SO_4\rightarrow Na_2SO_4+2H_2O\)
2 1 1
Vậy có 0,2 mol H2SO4 phản ứng với MgCO3
có 1 mol H2SO4 phản ứng với NaOH
\(m_{H_2SO_4}=1,2.98=117,6\left(g\right)\)
\(c,C\%_{H_2SO_4}=\dfrac{117,6}{200}.100\%=58,8\%\)
\(V_{CO_2}=0,2.22,4=4,48\left(l\right)\)
\(d,m_{Na_2SO_4}=1.142=142\left(g\right)\)
\(m_{ddNaOH}=\dfrac{80.100}{10}=800\left(g\right)\)
\(m_{ddH_2SO_4dư}=1.98:58,8\%\approx166,67\left(g\right)\)
\(m_{ddNa_2SO_4}=800+166,67=966,67\left(g\right)\)
\(C\%_{Na_2SO_4}=\dfrac{142}{966,67}.100\%\approx14,69\%\)

mH2SO4= \(\dfrac{300.7,35}{100}=22,05g\)
nH2SO4= \(\dfrac{22,05}{98}=0,225 mol\)
mHCl= \(\dfrac{200.7,3}{100}=14,6g\)
nHCl= \(\dfrac{14,6}{36,5}=0,4mol\)
H2SO4 + 2HCl → 2H2O + Cl2 ↑+ SO2 ↑
n trước pư 0,225 0,4
n pư 0,2 ← 0,4 → 0,4 → 0,2 → 0,2 mol
n sau pư dư 0,025 hết
a) mCl2= 0,2. 71= 14,2g
mSO2= 64. 0,2= 12,8g
mH2O= 18. 0,4=7,2g
mdd sau pư= 300 +200 -14,2 -12,8= 473g
C%dd H2O= \(\dfrac{7,2.100}{473}=1,52\)%
b) Mg + 2H2O → Mg(OH)2 + H2 ↑
x → 2x → x → x
Fe + 2H2O → Fe(OH)2 + H2↑
y → 2y → y → y
Gọi x,y lần lượt là số mol của Mg,Fe.
Ta có hệ phương trình:
24x + 56y = 8,7 x= \(\dfrac{5}{64}\)
⇒
2x + 2y = 0,4 y= \(\dfrac{39}{320}\)
VH2= 22,4. \((\dfrac{5}{64}+\dfrac{39}{320})\)= 4,48l
mhh MG(OH)2, Fe(OH)2= 8,7 +250 - 2.(\(\dfrac{5}{64}+\dfrac{39}{320}\)) = 2258,3g
mMg=24. \(\dfrac{5}{64}\)=1.875g
mFe= 8,7-1,875= 6,825g

\(2Al + 6HCl \rightarrow 2AlCl_3 + 3H_2\)
\(n_{Al}= \dfrac{10,8}{27}=0,4 mol\)
\(n_{HCl}= 0,3 mol\)
\(2Al + 6HCl \rightarrow 2AlCl_3 + 3H_2\)
Trước PƯ: 0,4 0,3
PƯ: 0,1 0,3 0,1 0,15
Sau PƯ: 0,3 0 0,1 0,15
Đây là mình làm tắt, bạn nên làm bài hết dư này theo cách của bạn
Sau PƯ: dd X có AlCl3 (0,1 mol) và 0,15 mol H2
\(V= 0,15 . 22,4=3,36 l\)
\(m_{dd sau pư}= m_{Al pư} + m_{dd HCl} - m_{H_2}= 0,1 . 27 + 300 - 0,15. 2=302 , 4g\)
C% X=\(\dfrac{ 0,1 . 133,5}{302,4}\). 100%= 4,41%

PTHH: \(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\uparrow\)
Ta có: \(\left\{{}\begin{matrix}n_{Al}=\dfrac{5,4}{27}=0,2\left(mol\right)\\n_{H_2SO_4}=\dfrac{200\cdot29,4\%}{98}=0,6\left(mol\right)\end{matrix}\right.\)
Xét tỉ lệ: \(\dfrac{0,2}{2}< \dfrac{0,6}{3}\) \(\Rightarrow\) Axit còn dư, Nhôm p/ứ hết
\(\Rightarrow\left\{{}\begin{matrix}n_{Al_2\left(SO_4\right)_3}=0,1\left(mol\right)\\n_{H_2}=0,3\left(mol\right)\\n_{H_2SO_4\left(dư\right)}=0,6-0,3=0,3\left(mol\right)\end{matrix}\right.\)\(\Rightarrow\left\{{}\begin{matrix}m_{Al_2\left(SO_4\right)_3}=0,1\cdot342=34,2\left(g\right)\\m_{H_2SO_4\left(dư\right)}=0,3\cdot98=29,4\left(g\right)\\m_{H_2}=0,3\cdot2=0,6\left(g\right)\\V_{H_2}=0,3\cdot22,4=6,72 \left(l\right)\end{matrix}\right.\)
Mặt khác: \(m_{dd\left(saup/ứ\right)}=m_{Al}+m_{ddH_2SO_4}-m_{H_2}=204,8\left(g\right)\)
\(\Rightarrow\left\{{}\begin{matrix}C\%_{Al_2\left(SO_4\right)_3}=\dfrac{34,2}{204,8}\cdot100\%\approx16,7\%\\C\%_{H_2SO_4\left(dư\right)}=\dfrac{29,4}{204,8}\cdot100\%\approx14,36\%\end{matrix}\right.\)
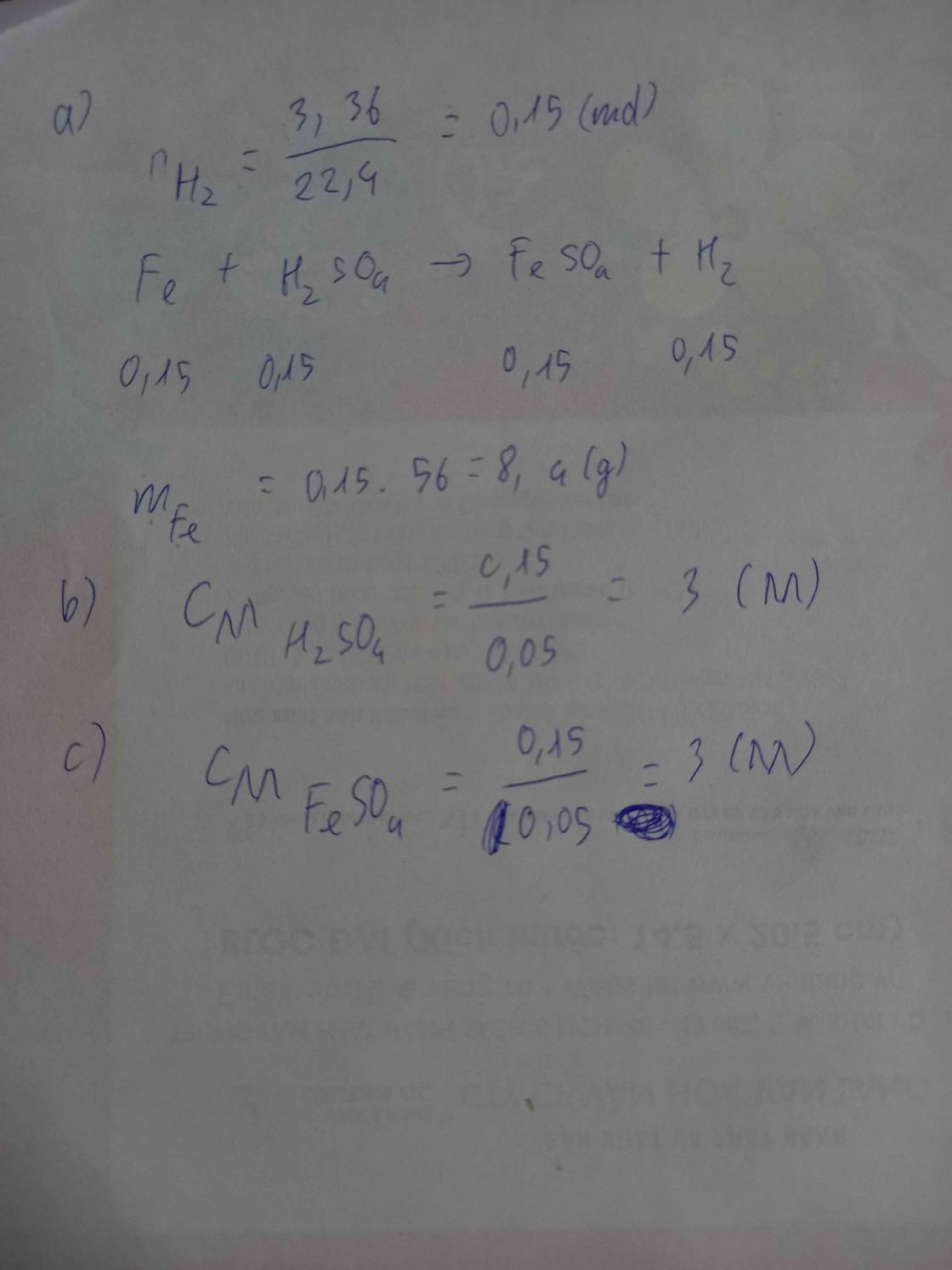
\(a)\ n_{Al} = \dfrac{8,1}{27} = 0,3(mol)\\ n_{H_2SO_4} = \dfrac{200.14,7\%}{98} = 0,3(mol)\\ 2Al + 3H_2SO_4 \to Al_2(SO_4)_3 + 3H_2\\ n_{H_2SO_4} = 0,3 < \dfrac{3}{2}n_{Al} = 0,45\)
Do đó, Al dư
\(n_{H_2} = n_{H_2SO_4} = 0,3(mol)\\ V = 0,3.22,4 = 6,72(lít)\)
b)
\(n_{Al\ pư} = \dfrac{2}{3}n_{H_2SO_4} = 0,2(mol)\\ n_{Al_2(SO_4)_3} = \dfrac{1}{3}n_{H_2SO_4} = 0,1(mol)\\ m_{dd} = 0,2.27 + 200 - 0,3.2 = 204,8(gam)\\ \Rightarrow C\%_{Al_2(SO_4)_3} =\dfrac{0,1.342}{204,8}.100\% = 16,7\%\)
pt: 2Al + 3H2SO4 \(\rightarrow\) Al2(SO4)3 +3H2
nAl =\(\dfrac{8,1}{27}=0,3\left(mol\right)\), \(m_{H_2SO_4}=14,7\%.200=29,4g\Rightarrow n_{H_2SO_4}=\dfrac{29,4}{98}=0,3mol\)
Theo pt: \(nAl:nH_2SO_4=\dfrac{0,3}{2}:\dfrac{0,3}{3}=0,15:0,1=3:2\)
=> Al dư
Theo pt: nH2 = nH2SO4 = 0,3mol => VH2 = 0,3.22,4=6,75 lít
b) theo pt: nAl2(SO4)3 = \(\dfrac{1}{3}nH_2SO_4=0,1mol\)
=> mAl2(SO4)3 = 0,1.342 = 34,2g
Áp dụng bảo toàn khối lượng
mAl + mH2SO4 = mAl2(SO4)3 dung dịch + mH2
=> m dung dịch Al2(SO4)3 = 8,1+200-0,3.2 = 207,5g
C% A = \(\dfrac{34,2}{207,5}.100\%\approx16,48\%\)