Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(n_{NaOH}=\dfrac{8}{40}=0,2mol\)
\(n_{H_2SO_4}=\dfrac{19,6}{98}=0,2\)\(mol\)
\(2NaOH+H_2SO_4\rightarrow Na_2SO_4+2H_2O\)
0,2 0,2
Dung dịch thu được là \(Na_2SO_4\) có môi trường trung hòa.

$n_{Al(OH)_3} = 0,05(mo)$
$NaOH + HCl \to NaCl + H_2O$
TH1 : Axit dư
$3HCl + Al(OH)_3 \to AlCl_3 + 3H_2O$
Theo PTHH :
$n_{HCl} = 0,2a + 0,05.3 = 0,1 \Rightarrow a = -0,25 <0 \to$ Loại
TH2 : NaOH dư
$NaOH + Al(OH)_3 \to NaAlO_2 + 2H_2O$
Ta có :
$n_{NaOH} = 0,1 + 0,05 =0,15(mol) \Rightarrow a = \dfrac{0,15}{0,2} = 0,3M$

Có [OH-] = 10-5
=> pH = 14 - 5 = 9 > 7
=> Môi trường dung dịch là kiềm
=>D

Đáp án B
nX = nNaOH – nHCl = 0,2.2,5 – 0,1 = 0,4 ( Vì X tác dụng với NaOH theo tỉ lệ 1:1)
Trong X chỉ có phenol + Br2 tạo kết tủa trắng
⇒ n phenol = n↓ = 33,1 : 331 = 0,1
⇒ nAxit = nX – n phenol = 0,3
Có mAxit = mX – m phenol ⇒ M Axit = (27,4 – 0,1.94) : 0,3 = 60
⇒ Axit đó là CH3COOH.

Chọn đáp án C
FeO → FeCl2
Sự hoán đổi: 10 →2Cl, mỗi lần thay thế như vậy (với 1 mol O chẳng hạn) thì khối lượng tăng 2.23,5-16 = 55 gam
→ nO/FeO =11/55 = 0,2 = nFeO
→ m= 0,2.72 = 14,4
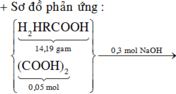
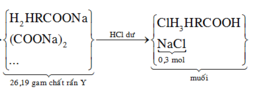
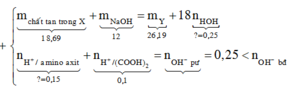
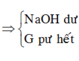


Đáp án C
nNaOH = m∕40 < m/36,5 = nHCl.
⇒ HCl dư, Dung dịch sau phản ứng có môi trường Axit.