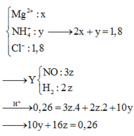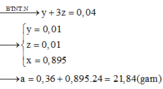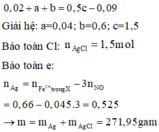Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án D
Quan sát quá trình 1:

BTKL có nH2O = 0,92 mol. Bảo toàn H chứng
tỏ trong X chứa 0,26 mol H+ dư như trên.
♦ Quá trình 2: để ý khí Y có M = 18,8
→ là H2 và NO. Quan sát quá trình chính:
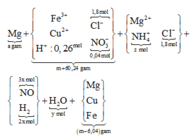
giải tỉ khối Y tìm tỉ lệ 2 khí NO : H2 là 3 : 2 rồi gọi các ẩn như sơ đồ:
• Ghép cụm: nH2O = 2nNO + 3nNH4 ⇄ y = 6x + 3z (1).
• bảo toàn nguyên tố N có: 3x + z = 0,04 mol (2).
• Bảo toàn nguyên tố H có: 4x + 2y + 4z = 0,26 mol (3)
Giải x = 0,01 mol; y = 0,09 mol; z = 0,01 mol ||→ bảo toàn điện tích có nMg2+ = 0,895 mol.
► Chỉ cần BTKL cả sơ đồ có ngay và luôn giá trị yêu cầu a = 21,84 gam

Đáp án C
Cho m gam hỗn hợp rắn gồm Fe, Fe(NO3)2 vào dung dịch chứa 0,08 mol Cu(NO3)2, 0,02 mol Fe(NO3)3 và HCl thu được dung dịch X và hỗn hợp hai khí không màu, có một khí hóa nâu trong không khí là NO
Ta có: M - Y = 76 3 nên khí còn lại là H2 và tỉ lệ số mol NO: H2 là 5:1.
Cho AgNO3 dư vào dung dịch X thấy thoát ra 0,045 mol khí NO nên H+ dư trong X là 0,18 mol, do vậy X không chứa NO3-.
Mặt khác vì còn lại rắn không tan nên trong X chỉ chứa Fe2+ nên X chứa HCl dư và FeCl2.
Do còn H+ dư nên Fe hết ® rắn còn lại là Cu 0,08 mol
→ 32 m 255 = 0 , 08 . 32 → m = 20 , 4 = 180 a + 56 b
Gọi số mol Fe(NO3)2 là a mol; Fe là b mol và HCl là c mol
Bảo toàn N: n N O = 2 a + 0 , 22 m o l → n H 2 = 0 , 4 a + 0 , 044
Bảo toàn H: c= 0,18+4(2a+0,22)+2(0,4a+0,044)
→ n F e C l 2 = 0 , 5 c - 0 , 09
Bảo toàn nguyên tố Fe: 0,02+a+b= 0,5c-0,09
Giải hệ: a=0,04; b=0,6; c=1,5
Bảo toàn Cl: n A g C l = 1 , 5 m o l
Bảo toàn e: n A g = n F e 3 + t r o n g X - 3 n N O = 0 , 66 - 0 , 045 . 3 = 0 , 525 → m = m A g + m A g C l = 271 , 95 g a m

Ta có nH2SO4 = 0,55 mol
nSO2 = 0,26 mol (axit nồng độ cao -> đặc), chất rắn là nCu = 0,035 mol
Tới đây ta giải hệ ta tìm được nCu = 0,047 + 0,035 = 0,082 ; nMg = 0,228
Xét phản ứng 2, nHNO3 = 0,8 mol, tác dụng hết với kim loại (Y chỉ chứa muối) Vì cả 2 kim loại hóa trị II nên:
3X + 8HNO3 -> 3X(NO3)2 + 2NO + 4H2O (1) => Đáp án B

Chọn đáp án D
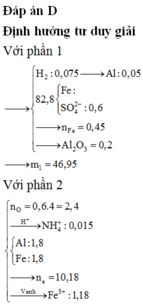
Xét phần 1: do sinh ra H2 ⇒ Al dư. nH2 = 0,075 mol ⇒ nAl dư = 0,05 mol.
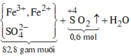
Rắn không tan là Fe. Ta có: 2H2SO4 + 2e → SO2 + SO42– + 2H2O.
⇒ nSO42– = nSO2 = 0,6 mol ⇒ nFe = (82,8 – 0,6 × 96) ÷ 56 = 0,45 mol.
8Al + 3Fe3O4 → 4Al2O3 + 9Fe ⇒ nAl2O3 = 0,45 × 4 ÷ 9 = 0,2 mol.
⇒ mphần 1 = 0,05 × 27 + 0,2 × 102 + 0,45 × 56 = 46,95(g) ⇒ m phần 2 = 187,8(g).
⇒ phần 2 gấp 4 lần phần 1 ⇒ phần 2 chứa 0,2 mol Al; 0,8 mol Al2O3; 1,8 mol Fe.
Ta có: nH+ = 4nNO + 2nNO2 + 2nO + 10nNH4+ ⇒ nNH4+ = 0,015 mol.
Đặt nFe(NO3)2 = b ⇒ a + b = nFe = 1,8 mol; Bảo toàn electron:
0,2 × 3 + 3a + 2b = 1,25 × 3 + 1,51 + 0,015 × 8. Giải hệ có: a = 1,18

Phản ứng nhiệt nhôm:
![]()
X tác dụng với NaOH thu được => Al dư (*)
Phản ứng xảy ra hoàn toàn (**)
Kết hợp (*), (**) => F e 3 O 4 hết => X gồm Fe, A l 2 O 3 và Al dư
Chú ý: Bài toán chia làm hai phần không bằng nhau
*Xét phần một
Số mol H2 thu được là: ![]()
Trong X, chỉ có Al2O3 và Al dư tác dụng với NaOH theo sơ đồ sau:
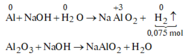
![]()
![]()
Chất rắn thu được là Fe
Chất rắn thu được tác dụng với H2SO4 đặc, nóng:
Sơ đồ phản ứng:
![]()
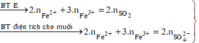
![]()
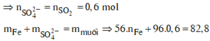
![]()
![]()
![]()
![]()
![]()
![]()
![]()
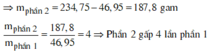
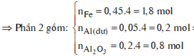
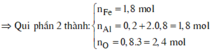
*Xét phần hai:
Số mol HNO3 là: ![]()
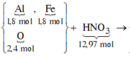
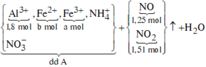
Các quá trình tham gia của H+:
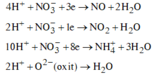
![]()
![]()
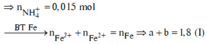
![]()
![]()
![]()


Ø Xét giai đoạn X tác dụng với dung dịch HCl:
![]()
![]() (NO là khí hóa nâu)
(NO là khí hóa nâu)
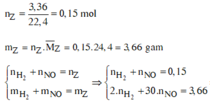
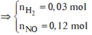
Thu được H2 => N O 3 - hết
Sơ đồ phản ứng:
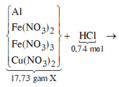
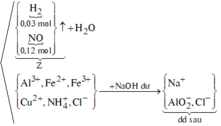
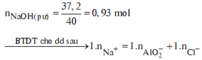
![]()
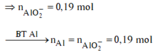
Các quá trình tham gia của H+:
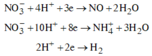
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
Ø Xét giai đoạn X cho vào H2O dư:
Al là kim loại mạnh hơn Fe và Cu.
![]()
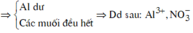
![]()
![]()
Sơ đồ phản ứng: 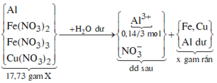
![]()
![]()
![]()
Đáp án C