Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Coi \(n_{Cu} = n_{FeO} = 1(mol)\\ n_{Fe} = x(mol)\)
Bảo toàn electron cho quá trình 1:
\(2n_{Fe} + 2n_{Cu} = 3n_{NO}\)
⇒ 2x + 2 = 3a(1)
Y gồm \(Cu(NO_3)_2,Fe(NO_3)_2\)
Bảo toàn electron cho quá trình 2 :
\(n_{Fe(NO_3)_2} = x + 1 = 3n_{NO}\)
⇒ x + 1 = 3b(2)
Lấy (1) : (2), ta có \(\dfrac{2x + 2}{x + 1} =\dfrac{3a}{3b} \Rightarrow \dfrac{a}{b} = 2\)

Chất rắn không tan là Cu chưa pư.
⇒ mCu (dư) = 6 (g)
Ta có: 56nFe + 64nCu (pư) = 30 - 6 (1)
\(n_{HNO_3}=0,52.2=1,04\left(g\right)\Rightarrow n_{NO}=\dfrac{1,04}{4}=0,26\left(mol\right)\)
BT e, có: 2nFe + 2nCu (pư) = 3nNO = 0,78(2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}n_{Fe}=0,12\left(mol\right)\\n_{Cu\left(pư\right)}=0,27\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\%m_{Cu}=\dfrac{0,27.64+6}{30}.100\%=77,6\%\)

Qui hỗn hợp Y về : Fe ; Cu ; O
Bảo toàn khối lượng : mFe + mCu + mO = mY
=> nO(Y) = 0,005 mol
Ta thấy : nNO = nHNO3 => Sau phản ứng không còn NO3- trong dung dịch.
Bảo toàn O : nO(Y) + 3nHNO3 = nNO + nH2O => nH2O = 0,145 mol
Bảo toàn H : nHCl + nHNO3 = nH+(X) + 2nH2O
=> nH+ dư = 0,02 mol
Bảo toàn điện tích trong X : 2nFe2+ + 3nFe3+ + 2nCu2+ + nH+ = nCl-
Mặt khác nFe2+ + nFe3+ = 0,08 mol
=> nFe2+ = 0,08 ; nFe3+ = 0
Khi cho AgNO3 vào :
3Fe2+ + 4H+ + NO3- -> 3Fe3+ + NO + 2H2O
0,015<- 0,02
Fe2+ + Ag+ -> Fe3+ + Ag
0,065
Cl- + Ag+ -> AgCl
0,24
=> m = 41,46g
=>B

Đáp án C
Quy đổi hỗn hợp về Fe (x mol); Cu (y mol) và S (z mol)
Bảo toàn S có
nS = n↓ = 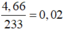 (mol)
(mol)
mX = 2,72 gam → 56x + 64y + 0,02.32 = 2,72 → 56x + 64y = 2,08 (1)
Do Y có thể hòa tan được Cu, bảo toàn electron có:
3.nFe + 2.nCu + 6.nS = 3.0,07 → 3x + 2y = 0,09 (2)
Từ (1) và (2) có: x = 0,02 và y = 0,015.
Dung dịch Y gồm: Fe3+: 0,02 mol; Cu2+: 0,015 mol; SO42- = 0,02 mol; NO3- = (0,5 – 0,07 = 0,43 mol) và có thể có H+
Bảo toàn điện tích → nH+ = 0,38 mol
Cho Cu vào Y có phản ứng:
3Cu + 8H+ + 2NO3- → 3Cu2+ + 2NO + 4H2O
0,1425 ← 0,38 0,43 mol
Cu + 2Fe3+ → Cu2+ + 2Fe2+
0,01 ← 0,02 mol
m = (0,01 + 0,1425).64 = 9,76 gam.
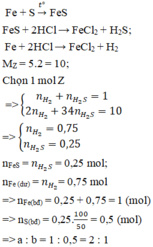
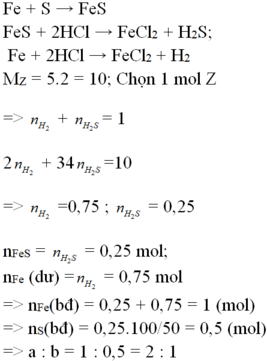
Chất rắn gồm : Ag,Cu dư
\(n_{Ag} = n_{AgNO_3} = 0,1(mol)\\ \Rightarrow n_{Cu} = \dfrac{15,92-0,1.108}{64} = 0,08(mol)\)
Gọi \(n_{Cu} = n_{Fe} = a(mol)\)
Dung dịch sau phản ứng :
\(Fe^{2+} : a + 0,14\\ Cu^{2+} : a - 0,08\\ NO_3^- : 0,1 + 0,14.3 = 0,52(mol)\)
Bảo toàn điện tích : 2(a+0,14) + 2(a -0,08) = 0,52
⇒ a = 0,1
Vậy \(n_{Fe^{2+}} = a + 0,14 = 0,24(mol)\)
Bảo toàn e :
\(n_{Fe^{2+}} = 3n_{NO}\\ \Rightarrow n_{NO} = \dfrac{0,24}{3} = 0,08(mol)\\ \Rightarrow V = 0,08.22,4 = 1,792(lít)\)
Đáp án C