Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Thí nghiệm 1:
\(m_{ddH_2SO_4}=500\cdot1,12=560g\)
\(\Rightarrow m_{H_2SO_4}=\dfrac{560\cdot19,6\%}{100\%}=109,76g\)
\(n_{H_2}=\dfrac{6,72}{22,4}=0,3mol\)
\(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\)
0,2 0,1 0,3
Chất rắn không tan thu được là Ag.
Thí nghiệm 2:
\(n_{SO_2}=\dfrac{8,96}{22,4}=0,4mol\)
\(BTe:3n_{Al}+n_{Ag}=2n_{SO_2}\)
\(\Rightarrow n_{Ag}=2\cdot0,4-3\cdot0,2=0,2mol\)
a)\(m_{Al}=0,2\cdot27=5,4g\)
\(m_{Ag}=0,2\cdot108=21,6g\)
b)Dung dịch B là \(Al_2\left(SO_4\right)_3\)
\(C_M=\dfrac{0,1}{0,5}=0,2M\)

Chất không tan là Ag.
=> mAg= 6,25(g)
nH2=0,25(mol)
PTHH: Zn + H2SO4 -> ZnSO4 + H2
-> nZn=nH2= 0,25(mol)
=>mZn= 0,25 . 65=16,25(g)
=>
%mAg = \(\dfrac{6,25}{6 , 25 + 16 , 25}\) . 100 ≈ 27,778%
⇒% mZn ≈ 72,222%

\(m_{Mg}=1,2\left(g\right)\)
=> \(n_{Mg}=\dfrac{1,2}{24}=0,05\left(mol\right)\)
\(n_{H_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
PTHH: Mg + 2HCl --> MgCl2 + H2
____0,05--------------------->0,05
2Al + 6HCl --> 2AlCl3 + 3H2
\(\dfrac{1}{30}\)<--------------------0,05
=> \(m_{Al}=\dfrac{1}{30}.27=0,9\left(g\right)\)
=> \(\left\{{}\begin{matrix}\%Al=\dfrac{0,9}{0,9+1,2}.100\%=42,857\%\\\%Mg=\dfrac{1,2}{0,9+1,2}.100\%=57,143\%\end{matrix}\right.\)

\(n_{H_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
PTHH: Zn + 2HCl -->ZnCl2 + H2
____0,2<----------------------0,2
=> mZn = 0,2.65 = 13 (g)
mCu = mrắn không tan = 19,5 (g)
\(\left\{{}\begin{matrix}\%Zn=\dfrac{13}{13+19,5}.100\%=40\%\\\%Cu=\dfrac{19,5}{13+19,5}.100\%=60\%\end{matrix}\right.\)
`n_(H_2)=4,48/22,4=0,2 (mol)`
Ta có PTHH: `Zn+2HCl --> ZnCl_2 +H_2`
Theo PT: `1`--------------------------------`1`
Theo đề: `0,2`------------------------------`0,2`
`m_(Zn)=0,2.65=13(g)`
Vì `Cu` không phản ứng với `HCl` nên `m_(chất rắn không tan)=m_(Cu)=19,5(gam)`
`%Zn=13/(13+19,5) .100%=40%`
`%Cu=100%-40%=60%`

2Al + 6HCl → 2 A l C l 3 + 3 H 2
a……….3/2.a (mol)
Mg + 2HCl → M g C l 2 + H 2
b....................b (mol)
4 gam rắn không tan là Cu, gọi số mol của Al và Mg lần lượt là a và b (mol). Ta có:
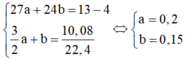
⇒ % m C u = 4 13 .100 = 30,77 % ⇒ % m A l = 0,2.27 13 .100 = 41,54 % ⇒ % m M g = 100 % − 30,77 % − 41,54 % = 27,69 %
⇒ Chọn C.

Do Cu ko phản ứng với HCl ở điều kiện thường
=> 6,72 lít khí là sản phẩm của Al tác dụng với HCl
Ta có: nH2 = 6,72 / 22,4 = 0,3 mol
PTHH: 2Al + 6HCl ===> 2AlCl3 + 3H2
0,2 <== 0,3
=> mAl = 0,2 x 27 = 5,4 gam
Và 3,2 gam chất rắn ko tan chính là Cu
Khi cho hỗn hợp trên tác dụng với H2SO4 đặc nóng
PTHH 3Al + 6H2SO4(đ, nóng) ===> Al2(SO4)3 + 3SO2 + 6H2O
0,2 0,2
Cu + 2H2SO4 ===> CuSO4 + SO2 + 2H2O
0,05 0,05
nCu = 3,2 / 64 = 0,05 mol
=> VSO2 (đktc)= (0,05 + 0,2) x 22,4 = 5,6 lít
Vì Ag không phản ứng với H2SO4 nên 6,72 lít khí H2 là sản phẩm của Al với H2SO4
=> 4,6 gam chất rắn không tan là khối lượng của Ag
PTHH: 2Al + 3H2SO4 ===> Al2(SO4)3 + 3H2
nH2 = 6,72 / 22,4 = 0,3 mol
=> nAl = 0,2 (mol)
=> mAl = 0,2 x 27 = 5,4 gam
=> %mAl = \(\frac{5,4}{4,6+5,4}.100\%=54\%\)
=> %mAg = 100% - 54% = 46%
sao suy ra số mol của al là 0,2 vậy