Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án C
nAg+ = 0,064 mol; nCu2+ = 0,4 mol;
nNO3– = 0,864 mol.
Ta có:
Al3+/Al > Fe2+/Fe > Cu2+/Cu > Fe3+/Fe2+ > Ag+/Ag.
⇒ các cation trong dung dịch xuất hiện theo thứ tự:
Al3+ → Fe2+ → Cu2+ → Fe3+ → Ag+.
► Ghép lần lượt các ion vào để thỏa bảo toàn điện tích:
Ghép 0,02 mol Al3+ và 0,01 mol Fe2+ vẫn chưa đủ.
⇒ ghép thêm (0,864 - 0,02 × 3 - 0,01 × 2) ÷ 2 = 0,392 mol Cu2+.
||⇒ Rắn gồm 0,064 mol Ag và (0,4 - 0,392 = 0,008) mol Cu
► m = 0,064 × 108 + 0,008 × 64 = 7,424(g)

Đáp án D
Ta có: ![]()
Cho AgNO3 dư vào X thu được kết tủa gồm AgCl 0,72 mol (bảo toàn nguyên tố Cl) và Ag 0,06 mol.
Nếu cho NaOH dư vào X thì lượng NaOH phản ứng 0,78 mol, do vậy
![]()
Do n A g = 0 , 06 m o l → n F e 2 + t r o n g X = 0 , 06 m o l
Ta có: n F e 2 + < n F e C l 3 và khối lượng rắn tăng do vậy Fe dư
Gọi số mol Mg là a mol, Fe là b mol
=> m = 24a + 56b + 0,06.27
Rắn Y sẽ chứa Cu 0,12 mol và Fe 0,1+b mol
=> 1,8275m = 0,12.64 + 56(0,1+b)
Dung dịch X chứa MgCl2 a mol, AlCl3 0,06 mol và FeCl2 0,06 mol
![]()
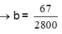
=> m = 8 gam

Đáp án D
Ta có:
n F e C l 3 = 0 , 16 ; n C u C l 2 = 0 , 12
Cho AgNO3 dư vào X thu được kết tủa gồm AgCl 0,72 mol (bảo toàn nguyên tố Cl) và Ag 0,06 mol.
Nếu cho NaOH dư vào X thì lượng NaOH phản ứng 0,78 mol, do vậy
n A l = 0 , 78 - 0 , 72 = 0 , 06 m o l
Do n A g = 0 , 06 → n F e + 2 t r o n g X = 0 , 06 m o l
Ta có: n F e 2 + < n F e C l 3 và khối lượng rắn tăng do vậy Fe dư
Gọi số mol Mg là a mol, Fe là b mol
→ m = 24 a + 56 b + 0 , 06 . 27
Rắn Y sẽ chứa Cu 0,12 mol và Fe 0,1+b mol
→ 1 , 8275 m = 0 , 12 . 64 + 56 ( 0 , 1 + b )
Dung dịch X chứa MgCl2 a mol, AlCl3 0,06 mol và FeCl2 0,06 mol
![]()
→ b = 67 2800
→ m = 8 g a m

Gọi x = nNa
Na + H2O → NaOH + 1 2 H2
x → x → 0,5x
Al + NaOH + H2O → NaAlO2 + 3 2 H2
x ← x → 1,5x
Do sau phản ứng, thu được chất rắn Y nên Al vẫn còn dư ⇒ NaOH hết
Vậy ∑nH2 = 0,5x + 1,5x = 8 , 96 22 , 4 ⇒ x = 0,2
⇒ mNa + mAl pư = 23x + 27x = 10g ⇒ mAl còn dư = 16,75 – 10 = 6,75g ⇒ Chọn A

Đáp án D
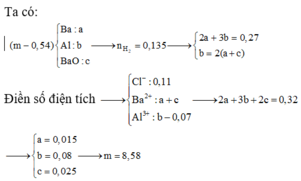
Cho hỗn hợp kim loại trên vào dung dịch chứa FeCl3 và CuCl2 sau phản ứng thu được dung dịch X và rắn Y. Cho AgNO3 dư vào X thấy AgNO3 phản ứng 0,54 mol và thu được kết tủa là AgCl và Ag.
Giải được số mol AgCl và Ag lần lượt là 0,48 và 0,06 mol.
Gọi số mol FeCl3 lần lượt là a thì số mol CuCl2 là 1,5a
Bảo toàn Cl: 3 a + 1 , 5 a . 2 = 0 , 48 → a = 0 , 08 m o l
Ta có số mol Ag là 0,06 nên số mol FeCl2 trong X phải là 0,06 mol.
Do vậy chỉ có Al phản ứng với dung dịch muối ban đầu vì số mol FeCl2 nhỏ hơn FeCl3.
→ n A l = 0 , 08 + 0 , 02 . 2 + 0 , 12 . 2 3 = 0 , 12 = n F e
Do vậy rắn Y chứa Fe 0,14 mol, Cu 0,12 mol
→ x = 15 , 52 g a m

Chọn C.
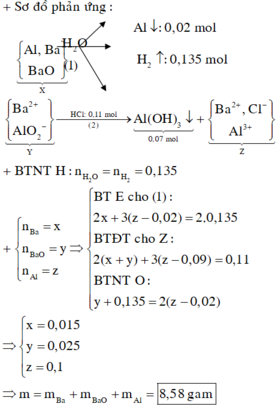
Hỗn hợp X gồm Al và Fe với số mol mỗi chất bằng 0,2 mol
Hỗn hợp Y gồm Cu(NO3)2 (0,2x mol) và AgNO3 (0,2y mol)
Hỗn hợp Z gồm Ag, Cu và Fe dư Þ nFe dư = 0,1 mol và 64.0,2x + 108.0,2y = 40,8 (1)
→ BT : e 0 , 2 . 3 + 2 . ( 0 , 2 - 0 , 1 ) = 0 , 2 x . 2 + 0 , 2 y (2). Từ (1), (2) suy ra: x = 1,5
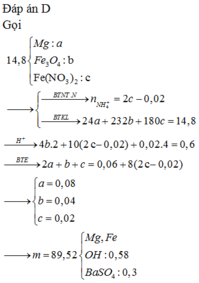
Đáp án C
Ta có
=> các cation trong dung dịch xuất hiện theo thứ tự:
Ghép lần lượt các ion vào để thoả bảo toàn điện tích:
Ghép 0,02 mol A l 3 + v à 0 , 01 m o l F e 2 + vẫn chưa đủ.
=> ghép thêm: (0,864 - 0,02.3 - 0,01.2) : 2 = 0,392 mol C u 2 +
=> Rắn gồm 0,064 mol Ag và (0,4 - 0,392 = 0,08) mol Cu
=> m = 0,064.108 + 0,008.64 = 7,424 (g)