Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án D
Sơ đồ quá trình phản ứng
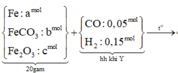

Hướng tư duy 1:
+ Xét khí Y1 có ![]()
![]()
+Xét hỗn hợp X1(sau khi quy đổi) có:
![]()
![]()
Do đó, trong 0,62 mol hỗn hợp khí có (0,67-b) mol NO (khí hóa nâu)
Bảo toàn nguyên tố Fe có:
![]()
= a + b = 2c mol
Bảo toàn O: ![]()
![]()
![]()
Bảo toàn e:
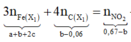
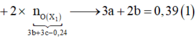
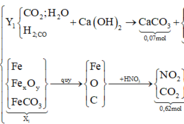
+ Xét hỗn hợp khí sau khi tác dụng H 2 S O 4 ta có:
![]()
![]()
Mà ![]()
=> giải hệ (1), (2), (3) ta được
![]()
Hướng tư duy 2:
Gọi x là số mol F e C O 3 bị nhiệt phân
Bảo toàn C ta có: ![]() = 0,05 mol
= 0,05 mol
=>
n
C
O
(
p
h
ả
n
ứ
n
g
)
= ![]()
![]()
+ Gọi a là số mol
F
e
C
O
3
phản ứng với
H
N
O
3
có ngay ![]()
+ Cho X phản ứng với H 2 S O 4 (đặc, nóng): (X chứa a+0,05 mol F e C O 3 )
Bảo toàn nguyên tố C có: ![]()
![]()
Bảo toàn e trong phản ứng với H N O 3 và H 2 S O 4 đặc nóng, có hệ:
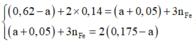
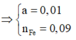
![]()
![]()

Đáp án C
· Phần 1 qua Ca(OH)2 dư:
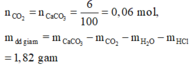
![]() Không khí bị hấp thụ là N2:
Không khí bị hấp thụ là N2:
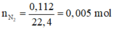
·Phần 2: Kết tủa thu được là AgCl
![]()
![]()
![]()
Vì
![]()
trong phần 1 có
![]()
Vậy khi đốt cháy 5,52 gam X tạo ra 0,18 mol CO2; 0,135 mol H2O; 0,015 mol N2; 0,06 mol HCl
· Áp dụng định luật bảo toàn khối lượng có:
= 44.0,18 + 18.0,135 + 28.0,015 + 36,5.0,06 – 5,52 = 7,44 gam
![]()
· Áp dụng định luật bảo toàn nguyên tố O có:
nO(X) = 2.0,18 + 0,135 – 2.0,2325 = 0,03 mol

X có công thức C6H11ONCl2. Vậy MX = 184

Đáp án A
Xử Lý hỗn hợp khí X: 3 khí đó chỉ có thể là NO, N2 và N2O.
NO + ½O2 → NO2 và bị giữ lại bởi NaOH.
⇒ Hỗn hợp khí Y chứa N2 và N2O với MTrung bình = 36 = MTrung bình cộng của 2 khí.
⇒ nN2 = nN2O || Đặt nNO = a và nN2 = nN2O = b ta có hệ:
a + 2b = 0,04 || 30a + 28b + 44b = 1,32 ||⇒ a = 0,02 và b = 0,01.
⇒ ∑ne cho nhận = 3nNO + 10nN2 + 8nN2O = 0,24 mol.
● Đặt số mol 2 kim loại lần lượt là x và y ta có hệ:
(24+17×2)x + (27+17×3)y = 6,42 || 2x + 3y = 0,24.
⇒ nMg = 0,03 và nAl = 0,06 mol ⇒ mHỗn hợp kim loại = 2,34 gam
+ Bảo toàn nguyên tố Nitơ ⇒ nHNO3 đã pứ = 0,24 + 0,02 + 0,01×2×2 = 0,3 mol.
⇒ ∑nHNO3 ban đầu = 0,3 + 0,3×0,15 = 0,345 mol.
⇒ mDung dịch HNO3 = 0 , 345 × 63 × 100 24 = 90,5625 gam



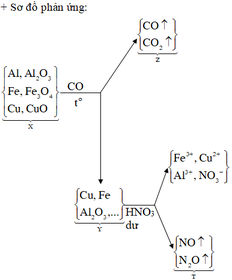

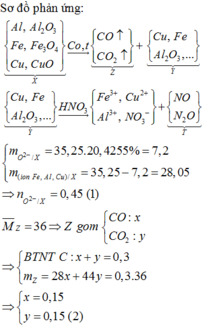
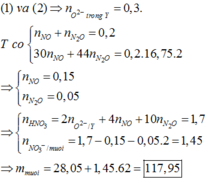
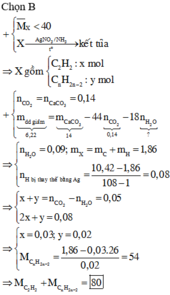
Đáp án C
Phương pháp:
- Tính số mol CO và H2.
- m↓ - mCO2 = m dung dịch giảm => mCO2
- Viết PTHH. Tính toán theo PTHH.
Hướng dẫn giải:
Ta có: