Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án B
Phương trình phản ứng:
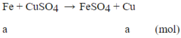
m tăng = (64-56).a = 1 ⇒a=0,125 mol
nFe = 0,125 ⇒nCu = (15-56.0,125)/64 = 0,125 mol
Thành phần phần trăm theo khối lượng:
⇒ % mCu = 53,33

Đáp án A
Gọi nZn = a; nFe = b thì nCu = a + b
Vì khối lượng chất rắn trước và sau phản ứng bằng nhau nên mZn + mFe = mCu
Do đó 65a + 56b = 64(a+b) ⇔ a = 8b
Vậy phần trăm khối lượng cúa Zn trong hỗn hợp ban đầu là:
% m Z n = 65 . 8 b 65 . 8 b + 56 b . 100 % = 90 , 27 %

CuSO4 → KL pư hết.
Gọi: \(\left\{{}\begin{matrix}n_{Zn}=a\left(mol\right)\\n_{Fe}=b\left(mol\right)\end{matrix}\right.\) ⇒ m = 65a + 56b (1)
BT e, có: 2a + 2b = 2nCu ⇒ nCu = a + b (mol) ⇒ m = 64(a + b) (2)
Từ (1) và (2) ⇒ 65a + 56b = 64a + 64b
⇒ a = 8b
\(\Rightarrow\%m_{Zn}=\dfrac{65a}{65a+56b}.100\%=\dfrac{65.8b}{65.8b+56b}.100\%\approx90,28\%\)

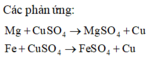
Dung dịch D gồm MgSO4 và FeSO4. Chất rắn B bao gồm Cu và Fe có thể dư
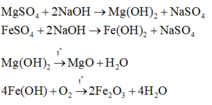
Gọi x, y là số mol Mg và Fe phản ứng. Sự tăng khối lượng từ hỗn hợp A (gồm Mg và Fe) so với hỗn hợp B (gồm Cu và Fe có thể dư) là
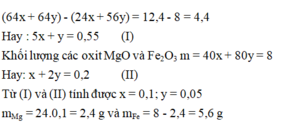
Đáp án C

Đáp án A
Ta có dãy điện hóa: ![]()
=>Zn phản ứng với C u 2 + trước
![]() khối lượng rắn giảm
khối lượng rắn giảm
![]() khối lượng rắn tăng
khối lượng rắn tăng
Do cuối cùng m rắn = m(g) =m hỗn hợp ban đầu =>tăng và giảm phải cân bằng với nhau.
Đặt nZn = x; nFe = y => m giảm = (65 - 64)x = x(g); m tăng = (64 - 65)y = 8y
m tăng = m giảm =>x = 8y =>%mZn = 65x/(65x - 56y)x100% = 90,27%

Đáp án A
Ta có dãy điện hóa: ![]()
=>Zn phản ứng với C u 2 + trước
![]()
=> Khối lượng rắn giảm
![]() => Khối lượng rắn tăng
=> Khối lượng rắn tăng
Do cuối cùng m rắn = m(g) =m hỗn hợp ban đầu =>tăng và giảm phải cân bằng với nhau.
Đặt n Z n = x ; n F e = y => m giảm = (65 - 64)x = x(g); m tăng = (64 - 56)y = 8y
m tăng = m giảm => x = 8y => %mZn = 65x : (65x - 56y).100% = 90,27%
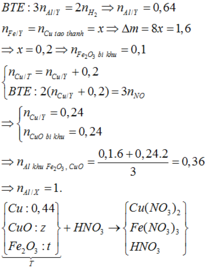
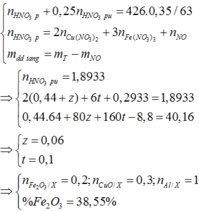
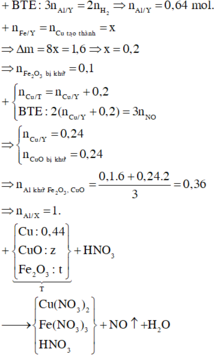
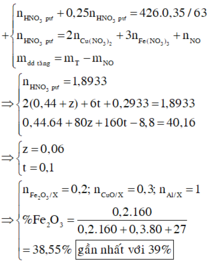

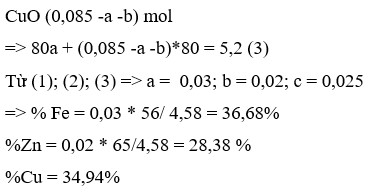
Đáp án D
Các phản ứng xảy ra:
Hỗn hợp rắn thu được khi cho hỗn hợp phản ứng với dung dịch CuSO4 gồm Cu, FeO và Fe2O3.