Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(a)Bte:3n_{Fe}+3n_{Al}=n_{Ag}\\ \Leftrightarrow n_{Ag_3}=0,1.3+0,1.3\\ \Leftrightarrow n_{Ag}=0,6mol\\ m_{rắn}=m_{Ag}=0,6.108=64,8g\\ BTNT\left(Ag\right):n_{Ag}=n_{AgNO_3}=0,6mol\\ V_{AgNO_3}=\dfrac{0,6}{2}=0,3l\\ BTNT\left(Al\right):n_{Al}=2n_{Al_2O_3}\\ \Leftrightarrow0,1=2n_{Al_2O_3}\\ \Leftrightarrow n_{Al_2O_3}=0,05mol\\ BTNT\left(Fe\right):n_{Fe}=2n_{Fe_2O_3}\\ \Leftrightarrow0,1=2n_{Fe_2O_3}\\ \Leftrightarrow n_{Fe_2O_3}=0,05mol \\ b=m_{oxit.bazo}=0,05.\left(160+102\right)=13,1g\)

Chất rắn gồm : Ag,Cu dư
\(n_{Ag} = n_{AgNO_3} = 0,1(mol)\\ \Rightarrow n_{Cu} = \dfrac{15,92-0,1.108}{64} = 0,08(mol)\)
Gọi \(n_{Cu} = n_{Fe} = a(mol)\)
Dung dịch sau phản ứng :
\(Fe^{2+} : a + 0,14\\ Cu^{2+} : a - 0,08\\ NO_3^- : 0,1 + 0,14.3 = 0,52(mol)\)
Bảo toàn điện tích : 2(a+0,14) + 2(a -0,08) = 0,52
⇒ a = 0,1
Vậy \(n_{Fe^{2+}} = a + 0,14 = 0,24(mol)\)
Bảo toàn e :
\(n_{Fe^{2+}} = 3n_{NO}\\ \Rightarrow n_{NO} = \dfrac{0,24}{3} = 0,08(mol)\\ \Rightarrow V = 0,08.22,4 = 1,792(lít)\)
Đáp án C

Có lẽ đề cho nung kết tủa trong không khí chứ không phải "để" bạn nhỉ?
PT: \(Zn+CuSO_4\rightarrow ZnSO_4+Cu\)
____0,04_____0,04_____0,04 (mol)
\(Fe+CuSO_4\rightarrow FeSO_4+Cu\)
0,03_____0,03______0,03 (mol)
⇒ nCuSO4 dư = 0,1 - 0,04 - 0,03 = 0,03 (mol)
- Dung dịch X gồm: ZnSO4: 0,04 (mol), FeSO4: 0,03 (mol) và CuSO4: 0,03 (mol)
PT: \(ZnSO_4+Ba\left(OH\right)_2\rightarrow Zn\left(OH\right)_{2\downarrow}+BaSO_{4\downarrow}\)
______0,04__________________0,04______0,04 (mol)
\(Zn\left(OH\right)_2+Ba\left(OH\right)_2\rightarrow BaZnO_2+2H_2O\)
\(FeSO_4+Ba\left(OH\right)_2\rightarrow Fe\left(OH\right)_{2\downarrow}+BaSO_{4\downarrow}\)
0,03____________________0,03______0,03 (mol)
\(CuSO_4+Ba\left(OH\right)_2\rightarrow Cu\left(OH\right)_{2\downarrow}+BaSO_{4\downarrow}\)
0,03____________________0,03_______0,03 (mol)
- Kết tủa thu được gồm: Fe(OH)2: 0,03 (mol), Cu(OH)2: 0,03 (mol) và BaSO4: 0,1 (mol)
PT: \(4Fe\left(OH\right)_2+O_2\underrightarrow{t^o}2Fe_2O_3+4H_2O\)
_________0,03_________0,015 (mol)
\(Cu\left(OH\right)_2\underrightarrow{t^o}CuO+H_2O\)
0,03_________0,03 (mol)
⇒ m = mFe2O3 + mCuO + mBaSO4 = 0,015.160 + 0,03.80 + 0,1.233 = 28,1 (g)

Coi \(n_{Cu} = n_{FeO} = 1(mol)\\ n_{Fe} = x(mol)\)
Bảo toàn electron cho quá trình 1:
\(2n_{Fe} + 2n_{Cu} = 3n_{NO}\)
⇒ 2x + 2 = 3a(1)
Y gồm \(Cu(NO_3)_2,Fe(NO_3)_2\)
Bảo toàn electron cho quá trình 2 :
\(n_{Fe(NO_3)_2} = x + 1 = 3n_{NO}\)
⇒ x + 1 = 3b(2)
Lấy (1) : (2), ta có \(\dfrac{2x + 2}{x + 1} =\dfrac{3a}{3b} \Rightarrow \dfrac{a}{b} = 2\)

Ba(OH)2 dư => Zn(OH)2 tan hết , kết tủa chỉ là Mg(OH)2.
\(n_{Mg}=n_{MgO}=\dfrac{52.6}{40}=1.315\left(g\right)\)
\(m_{Mg}=1.315\cdot24=31.56\left(g\right)>m_{hh}\)
Đề sai !

Gọi số mol Na, Zn là a, b
=> 23a + 65b = 14,3
n H2=\(\dfrac{2,24}{22,4}\)=0,1 mol
- Nếu Zn tan hết
2Na + 2H2O --> 2NaOH + H2
a-------------------->a---->0,5a
2NaOH + Zn --> Na2ZnO2 + H2
2b<----b-------------------->b
->\(\left\{{}\begin{matrix}2b\text{≤}a\\0,5a+b=14,3\end{matrix}\right.\) loại
=> Zn không tan hết => NaOH hết
PT:2Na + 2H2O --> 2NaOH + H2
a------------------->a---->0,5a
2NaOH + Zn --> Na2ZnO2 + H2
\ a--------------------------->0,5a
=> 0,5a + 0,5a = 0,1
=> a = 0,1
=> mNa = 0,1.23 = 2,3 (g)
=> mZn = 14,3 - 2,3 = 12(g)
PTP. ứng:
Fe+S----> FeS
Fe+ 2HCl--> FeCl2+H2
x x (mol)
FeS+ 2HCl--> FeCl2+ H2S
y y (mol)
Gọi n H2 và H2S trong C lần lượt là x và y mol, ta có hpt:
x+y=0.1
(2x+32y)/2(x+y)=13
--> x=0.02, y=0.08
--> tổng m Fe+n FeS= n Fe tỏng A=x+y=0.1 mol
m Fe=0.1.56=5.6 (g)
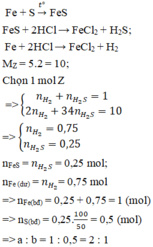
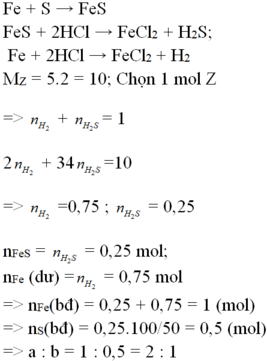
Phần trăm Fe có trong hỗn hợp ban đầu là
A. 18,22% B. 20,00 % C. 6,18% D.13,04%
P/s : Không phải tính số mol nhé