Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

A + H2SO4 → Hỗn hợp khí ⇒ Fe dư; khí Y gồm: H2 ( x mol) và H2S (y mol)
⇒ x + y = 0,1 mol (1)
Bảo toàn S: nH2S = nFeS = nS = y mol
nFe dư = nH2 = x
Bảo toàn Fe: nFe = nFeS + nFe dư = x + y
mX = 56(x + y ) + 32y = 7,2g (2)
Từ (1)(2) ⇒ x = 0,05 mol; y = 0,05 mol
MY = mY : nY = (0,05.2 + 0,05.34) : 0,1 = 18 ⇒ dY/H2 = 9
Gọi \(\left\{{}\begin{matrix}n_{Fe}=a\left(mol\right)\\n_{FeS}=b\left(mol\right)\end{matrix}\right.\left(đk:a,b>0\right)\)
TH1: S dư
Vậy toàn bộ lượng khí sinh ra là H2S
\(d_{Y\text{/}H_2}=d_{H_2S\text{/}H_2}=\dfrac{34}{2}=17\)
TH2: Fe dư
\(n_{khí}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
Bảo toàn KL: \(m_A=m_X=7,2\left(g\right)\)
PTHH:
\(Fe+2HCl\rightarrow FeCl_2+H_2\uparrow\)
a----------------------------->a
\(FeS+2HCl\rightarrow FeCl_2+H_2S\uparrow\)
b-------------------------------->b
Ta có hệ phương trình: \(\left\{{}\begin{matrix}56a+88b=7,2\\a+b=0,1\end{matrix}\right.\)
\(\Leftrightarrow a=b=0,05\left(TM\right)\)
\(M_Y=\dfrac{0,05.\left(2+34\right)}{0,1}=18\left(g\text{/}mol\right)\\ \rightarrow d_{Y\text{/}H_2}=\dfrac{18}{2}=9\)

PTHH: \(2Al+3S\underrightarrow{^{t^o}}Al_2S_3\)
Gọi số mol Al là x; S là y.
Ta có phương trình : \(27x+32y=10,2\left(g\right)\)
Vì cho Y tác dụng với HCl thu được hỗn hợp khí nên Al dư
\(\Rightarrow n_{Al_2S_3}=\dfrac{1}{3}n_S=\dfrac{y}{3}\left(mol\right)\)
\(\Rightarrow n_{Al\left(dư\right)}=x-\dfrac{2y}{3}\left(mol\right)\)
PTHH:
\(Al_2S_3+6HCl\rightarrow2AlCl_3+3H_2S\)
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
\(\Rightarrow n_{H2S}=3n_{Al2S3}=y\left(mol\right);n_{H2}=\dfrac{3}{2}n_{Al}=1,5x-y\left(mol\right)\)
\(M_Z=18\)
Áp dụng quy tắc đường chéo :
\(\Rightarrow\dfrac{n_{H2S}}{n_{H2}}=\dfrac{16}{16}\Rightarrow1,5x-y=y\)
\(\Rightarrow\left\{{}\begin{matrix}x=0,2\\y=0,15\end{matrix}\right.\)
\(\Rightarrow m_{Al}=0,2.27=5,4\left(g\right)\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{Al}=\dfrac{5,4}{10,2}=52,94\%\\\%m_S=100\%-52,94\%=47,06\%\end{matrix}\right.\)

\(n_{H2}=\dfrac{7,84}{22,4}=0,35\left(mol\right)\)
Pt : \(Mg+2HCl\rightarrow MgCl_2+H_2|\)
1 2 1 1
a 0,4 0,2 1a
\(Fe+2HCl\rightarrow FeCl_2+H_2|\)
1 2 1 1
b 0,3 0,15 1b
a) Gọi a là số mol của Mg
b là số mol của Fe
\(m_{Mg}+m_{Fe}=13,2\left(g\right)\)
⇒ \(n_{Mg}.M_{Mg}+n_{Fe}.M_{Fe}=13,2g\)
⇒ 24a + 56b = 13,2g (1)
Theo phương trình : 1a + 1b = 0,35(2)
Từ(1),(2), ta có hệ phương trình :
24a + 56b = 13,2g
1a + 1b = 0,35
⇒ \(\left\{{}\begin{matrix}a=0,2\\b=0,15\end{matrix}\right.\)
\(m_{Mg}=0,2.24=4,8\left(g\right)\)
\(m_{Fe}=0,15.56=8,4\left(g\right)\)
0/0Mg = \(\dfrac{4,8.100}{13,2}=36,36\)0/0
0/0Fe = \(\dfrac{8,4.100}{13,2}=63,64\)0/0
b) \(n_{HCl\left(tổng\right)}=0,4+0,3=0,7\left(mol\right)\)
200ml = 0,2l
\(C_{M_{ddHCl}}=\dfrac{0,7}{0,2}=3,5\left(M\right)\)
c) \(m_{muối.clorua}=\left(0,2.95\right)+\left(0,15.127\right)=38,05\left(g\right)\)
Chúc bạn học tốt

\(a,Fe+2HCl\rightarrow FeCl_2+H_2\\ CuO+2HCl\rightarrow CuCl_2+H_2O\\ n_{H_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\Rightarrow n_{Fe}=n_{H_2}=0,1\left(mol\right)\\ \Rightarrow\%m_{Fe}=\dfrac{0,1.56}{13,6}.100\%\approx41,176\%\\ \Rightarrow\%m_{CuO}\approx58,824\%\\ b,n_{CuO}=\dfrac{13,6-0,1.56}{80}=0,1\left(mol\right)\\ n_{HCl\left(p.ứ\right)}=2.\left(n_{Fe}+n_{CuO}\right)=2.\left(0,1+0,1\right)=0,4\left(mol\right)\\ \Rightarrow V_{ddHCl}=\dfrac{0,4}{2}=0,2\left(l\right)\)

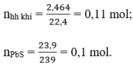
a) Phương trình hóa học của phản ứng:
Fe + 2HCl → FeCl2 + H2 (1)
FeS + 2HCl → FeCl2 + H2S (2)
H2S + Pb(NO3)2 → PbS + 2HNO3 (3)
b) Hỗn hợp khí thu được là H2 và H2S
Theo pt (3) ⇒ nH2S = nPbS = 0,1 mol
⇒ nH2 = nhh khí - nH2S = 0,11 – 0,1 = 0,01 mol
VH2 = 0,01 x 22,4 = 0,224l.
VH2S = 0,1 x 22,4 = 2,24l.
c) Theo PT (2) ⇒ nFeS = nH2S = 0,1 mol
⇒ mFeS = 0,1 × 88 = 8,8g.
Theo PT (1) nFe = nH2 = 0,01 mol ⇒ mFe = 56 × 0,01 = 0,56g.
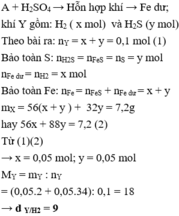



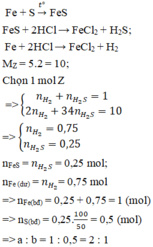
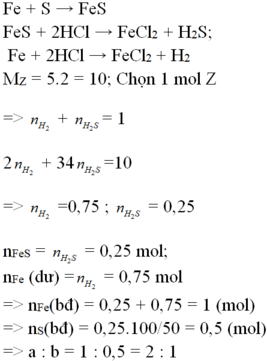
Gọi số mol Na, Zn là a, b
=> 23a + 65b = 14,3
n H2=\(\dfrac{2,24}{22,4}\)=0,1 mol
- Nếu Zn tan hết
2Na + 2H2O --> 2NaOH + H2
a-------------------->a---->0,5a
2NaOH + Zn --> Na2ZnO2 + H2
2b<----b-------------------->b
->\(\left\{{}\begin{matrix}2b\text{≤}a\\0,5a+b=14,3\end{matrix}\right.\) loại
=> Zn không tan hết => NaOH hết
PT:2Na + 2H2O --> 2NaOH + H2
a------------------->a---->0,5a
2NaOH + Zn --> Na2ZnO2 + H2
\ a--------------------------->0,5a
=> 0,5a + 0,5a = 0,1
=> a = 0,1
=> mNa = 0,1.23 = 2,3 (g)
=> mZn = 14,3 - 2,3 = 12(g)
PTP. ứng:
Fe+S----> FeS
Fe+ 2HCl--> FeCl2+H2
x x (mol)
FeS+ 2HCl--> FeCl2+ H2S
y y (mol)
Gọi n H2 và H2S trong C lần lượt là x và y mol, ta có hpt:
x+y=0.1
(2x+32y)/2(x+y)=13
--> x=0.02, y=0.08
--> tổng m Fe+n FeS= n Fe tỏng A=x+y=0.1 mol
m Fe=0.1.56=5.6 (g)