Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(n_{Fe}=\dfrac{5,6}{56}=0,1\left(mol\right)\)
Pt : \(Fe+H_2SO_4\rightarrow FeSO_4+H_2|\)
1 1 1 1
0,1 0,1 0,1
a) \(n_{H2SO4}=\dfrac{0,1.1}{1}=0,1\left(mol\right)\)
\(V_{ddH2SO4}=\dfrac{0,1}{2}=0,05\left(l\right)\)
b) \(n_{FeSO4}=\dfrac{0,1.1}{1}=0,1\left(mol\right)\)
\(C_{M_{FeSO4}}=\dfrac{0,1}{0,05}=2\left(M\right)\)
Chúc bạn học tốt

So sánh thể tích khí hiđro sinh ra
TN1 : Dùng dư axit để toàn lượng Zn tham gia phản ứng.
Theo (1) : 0,1 mol Zn điều chế được 0,1 mol H 2
Theo (2) : 0,1 mol Zn điều chế được 0,1 mol H 2
Kết luận : Những thể tích khí hiđro thu được trong thí nghiệm 1 là bằng nhau.
TN 2 - Dùng dư Zn để toàn lượng axit tham gia phản ứng.
Theo (1) : 0,1 mol HCl điều chế được 0,05 mol H 2
Theo (2) : 0,1 mol H 2 SO 4 điều chế được 0,1 mol H 2
Kết luận . Những thể tích khí hiđro thu được trong thí nghiệm 2 là không bằng nhau. Thể tích khí hiđro sinh ra ở (2) nhiều gấp 2 lần ở (1).

Theo gt ta có: $n_{Cu_2S}=n_{FeS}=0,1(mol)$
Bảo toàn e ta có: $n_{SO_2}=0,95(mol)\Rightarrow V=21,28(l)$
Bảo toàn nguyên tố Cu và Fe ta có: $n_{CuSO_4}=0,2(mol);n_{Fe_2(SO_4)_3}=0,05(mol)$
$\Rightarrow m_{muoi}=52(g)$
Bảo toàn S ta có: $n_{H_2SO_4}=1,1(mol)$
Bảo toàn Cu và Fe ta có: $n_{CuO}=0,2(mol);n_{Fe_2O_3}=0,05(mol)$
$\Rightarrow a=36(g)$
Theo gt ta có: nCu2S=nFeS=0,1(mol)nCu2S=nFeS=0,1(mol)
Bảo toàn e ta có: nSO2=0,95(mol)⇒V=21,28(l)nSO2=0,95(mol)⇒V=21,28(l)
Bảo toàn nguyên tố Cu và Fe ta có: nCuSO4=0,2(mol);nFe2(SO4)3=0,05(mol)nCuSO4=0,2(mol);nFe2(SO4)3=0,05(mol)
⇒mmuoi=52(g)⇒mmuoi=52(g)
Bảo toàn S ta có: nH2SO4=1,1(mol)nH2SO4=1,1(mol)
Bảo toàn Cu và Fe ta có: nCuO=0,2(mol);nFe2O3=0,05(mol)nCuO=0,2(mol);nFe2O3=0,05(mol)
⇒a=36(g
ok nha

Pt:
Fe3O4 + 4H2SO4 → FeSO4 + Fe2(SO4)3 + 4H2O
0,1 → 0,4 0,1 0,1
Cu + Fe2(SO4)3 → CuSO4 + 2FeSO4
0,1 ←0,1 → 0,1 0,2
Rắn B là 0,1 mol Cu → x = 6,4 (g)
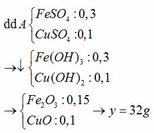

\(Fe+H_2SO_4 \to FeSO_4+H_2\\ n_{H_2}=0,15(mol)\\ a/\\ n_{Fe}=n_{H_2}=0,15(mol)\\ m_{Fe}=0,15.56=8,4(g)\\ b/\\ n_{H_2SO_4}=n_{H_2}=0,15(mol)\\ CM_{H_2SO_4}=\dfrac{0,15}{2}=0,75M c/\\ n_{FeSO_4}=n_{H_2}=0,15(mol)\\ CM_{FeSO_4}=\dfrac{0,15}{0,2}=0,75M\\\)

Đốt cháy hoàn toàn 0,1 mol một amin no, mạch hở X bằng oxi vừa đủ, thu được 0,5 mol hỗn hợp Y gồm khí và hơi. Cho 4,6 gam X tác dụng với dung dịch HCl (dư), số mol HCl phản ứng là:
A. 0,1. B. 0,4. C. 0,3. D. 0,2.
bạn có Pư: CnH2n+2+kNk ---> nCO2 + (n+1+0,5k)H2O + k/2N2
0,1 0,1n 0,1(n+1+0,5k) 0,05k
=> 0,1n + 0,1(n+1+0,5k) + 0,05k = 0,5
=> 0,2n + 0,1k = 0,4
=> n = 1, k = 2 => CH6N2 ( 2 chức )
=> n CH6N2 = 0,1 mol => n HCl = 0,2 mol => đáp án D
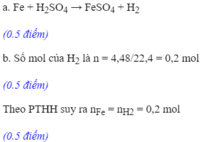

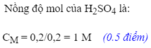
nFeSO4=15,2/152=0,1(mol)
PTHH: 2 FeSO4 + 2H2SO4(đ) -to-> Fe2(SO4)3 + SO2 + 2 H2O
0,1_______________0,1_________0,05______0,1(mol)
=> Chọn A
Cho 15,2 gam muối sắt (II) sunfat tác dụng với dung dịch H2SO4 đặc nóng, dư, sau phản ứng thu được dung dịch X và khí SO2. Tính số mol H2SO4 đã tham gia phản ứng
A. 0,1 mol.
B. 0,2 mol
C. 0,3 mol.
D. 0,4 mol.