Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(Mg+2H_2SO_4\buildrel{{t^o}}\over\longrightarrow MgSO_4+SO_2+2H_2O\\ Ca(OH)_2+SO_2 \to CaSO_3+H_2O n_{Mg}=\frac{12}{24}=0,5(mol)\\ n_{SO_2}=n_{Mg}=0,5(mol)\\ n_{CaSO_3}=n_{SO_2}=0,5(mol)\\ m_{CaSO_3}=0,5.120=60(g)\\ \to D \)

\(R+H_2SO_4\rightarrow RSO_4+H_2\\ n_R=n_{H_2SO_4}=0,2.1=0,2\left(mol\right)\\ M_R=\dfrac{12,8}{0,2}=64\left(\dfrac{g}{mol}\right)\)
Thật ra nó hơi vô lí vì anh thấy 200ml dd H2SO4 là dung dịch loãng, PT như trên, tính ra đồng mà đồng không tác dụng axit sunfuric loãng. Em hỏi lại cô đề bài nha :D

Đặt CTHH của oxit là RO
Ta có: \(n_{CaCO_3}=n_{kt}=\dfrac{50}{100}=0,5\left(mol\right)\)
PTHH:
\(RO+CO\xrightarrow[]{t^o}R+CO_2\)
0,5<-----------------0,5
\(Ca\left(OH\right)_2+CO_2\rightarrow CaCO_3\downarrow+H_2O\)
0,5<-----0,5
\(\Rightarrow M_{RO}=\dfrac{36}{0,5}=72\left(g/mol\right)\\ \Rightarrow M_R=72-16=56\left(g/mol\right)\)
Vậy R là Fe. CTHH của oxit sắt là FeO
Chọn C

nH2 = 0,13 mol; nSO2 = 0,25 mol
Ta có
2H+ + 2e → H2 Cu → Cu2+ + 2e
0,26 ←0,13 0,12 0,24
S+6 + 2e → S+4
0,5 ← 0,25
TH1: M là kim loại có hóa trị không đổi
=> nCu = (0,5 – 0,26) : 2 = 0,12 mol => mCu = 7,68g
=> mM = 3,12g (loại vì khối lượng của M lớn hơn của Cu)
TH2: M là kim loại có hóa trị thay đổi
Do M không có hóa trị I do đó khi phản ứng với HCl thì M thể hiện hóa trị II
M + 2HCl → MCl2 + H2
0,13 ← 0,13
Do M có hóa trị thay đổi => khi phản ứng với H2SO4 đặc nóng thì M thể hiện hóa trị III
2M + 6H2SO4 → M2(SO4)3 + 3SO2 + 6H2O
0,13 → 0,195
Cu + 2H2SO4 → CuSO4+ SO2 + 2H2O
0,055 ← 0,055
=> mM = 10,8 – 0,055 . 64 = 7,28g
=> MM = 56 => Fe
Ta có số mol của Cu và Fe trong 10,8 g lần lượt là 0,055 và 0,13 mol
=> Trong 5,4g có số mol Cu và Fe lần lượt là 0,0275 và 0,065 mol
nAgNO3 = 0,16mol
Fe + 2AgNO3 → Fe(NO3)2 +2Ag
0,065 0,13 0,065 0,13
Cu + 2AgNO3 → Cu(NO3)2 + 2Ag
0,015 0,03 0,03
=> nCu dư = 0,0275 – 0,015 = 0,0125mol
m = mCu dư + mAg = 0,0125 . 64 + 0,16 . 108 = 18,08g

a) Nhận xét: 33,84g X > 16g rắn → kim loại còn dư.
Chú ý: sau một thời gian ám chỉ các chất tham gia đều dư.
Giả sử số mol của Mg, Fe lần lượt là x, y
Tăng giảm khối lượng: (64 – 24) . x + (64 – 56) . y = 38,24 – 33,84 (1)
Chất rắn bao gồm MgO: x; Fe2O3: 0,5y; CuO: a – x – y
=> 40x + 160 . 0,5y + 80(a – x – y) = 16 (2)
Từ (1) và (2) => 10a + y = 2,55
amax <=> y = 0 => amax = 0,255
b) giá trị a đạt max thì Fe chưa tham gia pứ.
Giả sử số mol Mg dư là: z (mol) 19,12g Z cho 0,48 mol SO2 → 38,24g Z cho 0,96 mol SO2
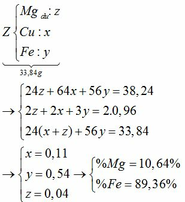
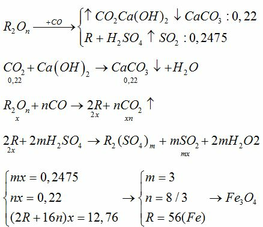



Ca(OH)2 + SO2 -------> CaSO3 + H2O
\(n_{CaSO_3}=n_{SO_2}=0,2\left(mol\right)\)
Z + 2H2SO4 --------> ZSO4 + SO2 + 2H2O
Ta có : \(n_Z=n_{SO2}=0,2\left(mol\right)\)
=> MZ= \(\dfrac{12,8}{0,2}=64\left(Cu\right)\)
=> Chọn C
\(2Z+2nH_2SO_4 \buildrel{{t^o}}\over\longrightarrow Z_2(SO_4)_n+nSO_2+2H_2O\\ Ca(OH)_2+SO_2 \to CaSO_3+H_2O\\ n_{CaSO_3}=\frac{24}{120}=0,2(mol)\\ n_{CaSO_3}=n_{SO_2}=0,2(mol)\\ n_Z=\frac{2}{n}.n_{SO_2}=\frac{2}{n}.0,2=\frac{0,4}{n}(mol)\\ M_Z=\frac{12,8n}{0,4}=32n (g/mol)\\ n=2; Z=64 (Cu)\\ \to C\)