Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Để lượng kết tủa không đổi thì KOH cần tối thiểu là vừa đủ để hoà tan hết A l ( O H ) 3 . Tổng số mol KOH là: 0,13 + 0,1 + 0,3 + 0,9 + 0,3 = 1,73 mol
Thể tích dung dịch KOH là: 1,73 : 5 = 0,346 lít = 346 ml

B3:
Bài 3 người ta cho các kim loại sau đây là những kim loại nào thế?
B2:
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\\ Mg+2HCl\rightarrow MgCl_2+H_2\\ AlCl_3+3NaOH\rightarrow3NaCl+Al\left(OH\right)_3\downarrow\\ MgCl_2+2NaOH\rightarrow Mg\left(OH\right)_2\downarrow+2NaCl\\ Al\left(OH\right)_3+NaOH\rightarrow NaAlO_2+H_2O\\ Mg\left(OH\right)_2\rightarrow\left(t^o\right)MgO+H_2O\\ Đặt:n_{Al}=a\left(mol\right);n_{Mg}=b\left(mol\right)\left(a,b>0\right)\\ \Rightarrow\left\{{}\begin{matrix}27a+24b=10\\40b=6\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}a=\dfrac{32}{135}\\b=0,15\end{matrix}\right.\\ \Rightarrow\%m_{Mg}=\dfrac{0,15.24}{10}.100\%=36\%\)

Đáp án B.
nFe = 0,2 mol; nZn = 0,1 mol
NaOH + H2S→NaHS + H2O
![]()

mCu = 2 (g)
Gọi số mol Al, Fe là a, b (mol)
=> 27a + 56b = 10,3 - 2 = 8,3 (1)
\(n_{H_2}=\dfrac{5,6}{22,4}=0,25\left(mol\right)\)
PTHH: 2Al + 6HCl --> 2AlCl3 + 3H2
a--------------------->1,5a
Fe + 2HCl --> FeCl2 + H2
b---------------------->b
=> 1,5a + b = 0,25 (2)
(1)(2) => a = 0,1 (mol); b = 0,1 (mol)
=> \(\left\{{}\begin{matrix}\%Al=\dfrac{0,1.27}{10,3}.100\%=26,21\%\\\%Fe=\dfrac{0,1.56}{10,3}.100\%=54,37\%\\\%Cu=\dfrac{2}{10,3}.100\%=19,42\%\end{matrix}\right.\)
\(n_{HCl}=2.n_{H_2}=0,5\left(mol\right)\)
=> \(V_{dd.HCl}=\dfrac{0,5}{2}=0,25\left(l\right)\)

\(Đặt:n_{Al}=a\left(mol\right),n_{Fe}=b\left(mol\right)\)
\(m_{hh}=27a+56b=8.3\left(g\right)\left(1\right)\)
\(n_{H_2}=\dfrac{5.6}{22.4}=0.25\left(mol\right)\)
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
\(Tathấy:\)
\(n_{HCl}=2n_{H_2}=2\cdot0.25=0.5\left(mol\right)\)
\(V_{ddHCl}=\dfrac{0.5}{0.2}=2.5\left(l\right)\)
\(n_{H_2}=1.5a+b=0.25\left(mol\right)\left(2\right)\)
\(\left(1\right),\left(2\right):a=b=0.1\)
\(C_{M_{AlCl_3}}=\dfrac{0.1}{2.5}=0.04\left(M\right)\)
\(C_{M_{FeCl_2}}=\dfrac{0.1}{2.5}=0.04\left(M\right)\)
Chúc em học tốt !!!
a, Ta có: \(n_{H_2}=\dfrac{5,6}{22,4}=0,25\left(mol\right)\)
BTNT H, có: \(n_{HCl}=2n_{H_2}=0,5\left(mol\right)\)
\(\Rightarrow V_{HCl}=\dfrac{0,5}{0,2}=2,5\left(l\right)\)
b, Giả sử: \(\left\{{}\begin{matrix}n_{Al}=x\left(mol\right)\\n_{Fe}=y\left(mol\right)\end{matrix}\right.\)
⇒ 27x + 56y = 8,3 (1)
Các quá trình:
\(Al^0\rightarrow Al^{+3}+3e\)
x___________ 3x (mol)
\(Fe^0\rightarrow Fe^{+2}+2e\)
y____________2y (mol)
\(2H^++2e\rightarrow H_2^0\)
______0,5__0,25 (mol)
Theo ĐLBT mol e, có: 3x + 2y = 0,5 (2)
Từ (1) và (2) ⇒ x = y = 0,1 (mol)
BTNT Al và Fe, có: \(\left\{{}\begin{matrix}n_{AlCl_3}=n_{Al}=0,1\left(mol\right)\\n_{FeCl_3}=n_{Fe}=0,1\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow C_{M_{AlCl_3}}=C_{M_{FeCl_3}}=\dfrac{0,1}{2,5}=0,04M\)
Bạn tham khảo nhé!

Gọi a,b lần lượt là số mol của Al, Fe trong hỗn hợp ban đầu
=> 27a+56b=8,3 (1)
\(n_{H_2}=\dfrac{5,6}{22,4}=0,25mol\)
Ta có quá trình trao đổi elcetron
\(Al^0\rightarrow Al^{+3}+3e\)
a----------------3a--(mol)
\(Fe^0\rightarrow Fe^{+2}+2e\)
b----------------2b--(mol)
\(2H^{-1}+2e\rightarrow H_2^0\)
----------0,5------0,25-(mol)
Áp dụng định luật bảo toàn e ta có: 3a+2b=0,5 (2)
Giải hệ phương trình gồm (1) và (2) ta được: \(\left\{{}\begin{matrix}a=0,1\\b=0,1\end{matrix}\right.\)
\(\left[{}\begin{matrix}m_{Al}=0,1\cdot27=2,7g\\m_{Fe}=0,1\cdot56=5,6g\end{matrix}\right.\)

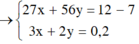
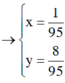
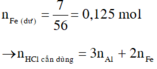
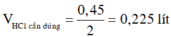
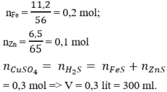
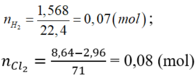
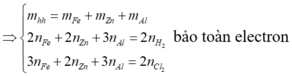
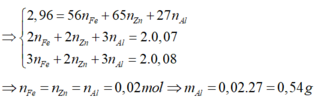
Dư kim loại \(\Rightarrow\) HCl hết
\(n_{HCl}=0,2\left(mol\right)\)
\(m_{X_{pu}}=12-7=5\left(g\right)\)
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
Giải hệ phương trình :
\(\left\{{}\begin{matrix}27a+56b=5\\3a+2b=0,2\end{matrix}\right.\rightarrow\left\{{}\begin{matrix}a=\frac{1}{95}\\b=\frac{8}{95}\end{matrix}\right.\)
Trong 5g X có 1/95 mol Al ; 8/95 mol Fe
\(\Rightarrow\) 12g X có 12/475 mol Al , 96/475 mol Fe
\(\rightarrow n_{HCl}=3n_{Al}+2n_{Fe}=0,48\left(mol\right)\)
\(\rightarrow V_{HCl}=0,24\left(l\right)=240\left(ml\right)\)
Mik vẫn hk hiểu cho lắm bn có thể giải rỏ hơn hk