Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án C
n(CO32–) = 0,2 mol; n(HCO3–) = 0,3 mol.
→ tỉ lệ 2 : 3.
→ 2x và 3x là số mol CO32– và HCO32– đã phản ứng
→ n(H+) = 2x.2 + 3x = 0,42 => x = 0,06 → n(CO2) = 2x + 3x = 0,3 mol.
Có n(OH–) = 0,36
Xét tỉ lệ T = n(OH–) / n(CO2) thấy tạo ra đồng thời 2 muối CO32– và HCO3–.
→ n(CO32–) = 0,06; n(HCO3–) = 0,24
n(Ba2+) = 0,08 → n(BaCO3) = 0,06 → m(BaCO3) = 11,82 gam.

Đáp án A
Trong 300 ml dung dịch X có m gam Al 2 SO 4 3 , suy ra trong 150 ml dung dịch X sẽ có 0,5m gam Al 2 SO 4 3 và có số mol là x.
Lượng Al 2 SO 4 3 phản ứng ở 2 thí nghiệm là như nhau. Lượng OH - ở TN2 nhiều hơn ở TN1, lượng kết tủa (y mol) ở TN2 ít hơn ở TN1 (2y mol). Chứng tỏ ở TN2 kết tủa Al OH 3 đã bị hòa tan một phần, ở TN1 kết tủa có thể bị hòa tan hoặc chưa bị hòa tan.
● Nếu ở TN1 kết tủa Al OH 3 chưa bị hòa tan, áp dụng bảo toàn điện tích trong các dung dịch sau phản ứng, ta có :
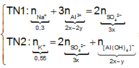
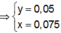
![]() thỏa mãn
thỏa mãn
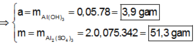
● Ở TN1 kết tủa Al OH 3 đã bị hòa tan, áp dụng bảo toàn điện tích cho dung dịch sau phản ứng, ta có:
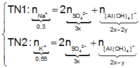
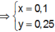
![]() (loại) (*)
(loại) (*)
PS : Nếu không sử dụng biểu thức (*) để biện luận loại trường hợp không thỏa mãn thì sẽ tính ra đáp án B. Nhưng đó là kết quả sai.

Trong 100ml dung dịch X có 0,1 mol Ba2+, 0,15 mol HCO3-
Trong 200ml dung dịch X có 0,2 mol Cl-
Do đó trong 50ml dung dịch X có 0,05 mol Ba2+, 0,075 mol HCO3- , 0,05 mol Cl- và x mol K+.
Theo định luật bảo toàn điện tích được x = 0,025.
Khi cô cạn xảy ra quá trình: 2HCO3- ⟶ CO32- + CO2 + H2O
Do đó: n C O 3 2 - = 0 , 0375
Vậy khối lượng chất rắn khan thu được là: m K + + m B a 2 + + m C O 3 2 - + m C l - = 11 , 85 ( g a m )
Đáp án C

Đáp án A
Dung dịch sau phản ứng chắc chắn có chứa các ion K + , Na + , Cl - . Mặt khác, n K + + n Na + > n Cl - , suy ra dung dịch sau phản ứng còn chứa ion âm, đó là Al OH 4 - . Theo bảo toàn điện tích, ta có :

![]()
![]()
= 0,05 mol
![]()

Đáp án A.
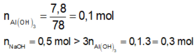
=> xảy ra 2 phản ứng sau:
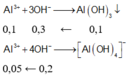
n A l 3 + = 0 , 15 m o l
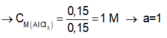

Ta có:
\(\left\{{}\begin{matrix}n_{NaOH}=\frac{300.8\%}{40}=0,6\left(mol\right)\\n_{Al2\left(SO4\right)3}=0,15.1=0,15\left(mol\right)\end{matrix}\right.\)
\(PTHH:Al_2\left(SO_4\right)_3+6NaOH\rightarrow2Al\left(OH\right)_3+3Na_2SO_4\)
Ban đầu:___0,15_______0,6____________
Phứng :____0,1_________0,6_________0,2_______
Sau : ______0,05________0_________0,2____________
\(\Rightarrow m_{Al\left(OH\right)3}=0,2.78=15,6\left(g\right)\)


=> Chọn đáp án B.