Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Giải thích:
nOH = 0,03 mol và nAl3+ = 0,02mol
Khi cho dung dịch NaOH vào thì
Al3+ + 3OH- → Al(OH)3
Ban đầu : 0,02 mol 0,03 mol
Sau PƯ 0,01 0 0,01 mol
→ mAl(OH)3 = 0,78 g
Đáp án D

Chọn đáp án C
● Gọi số mol NaOH dùng ở lần 1 là a mol ta có sơ đồ.
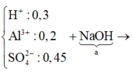
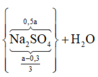
● ⇒ Với nNaOH = (a + 0,45) mol thì nAl(OH)3 = a - 0 , 3 6
+ Ta có sơ đồ:

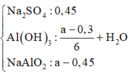
⇒ Ta có nAl(OH)3 = 4nAl(OH)3 – (nNaOH – nH+)
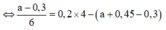
a = 0,6 mol ⇒ VNaOH = 0,6 lít = 600 ml ⇒ Chọn C

Đáp án A
Trong 300 ml dung dịch X có m gam Al 2 SO 4 3 , suy ra trong 150 ml dung dịch X sẽ có 0,5m gam Al 2 SO 4 3 và có số mol là x.
Lượng Al 2 SO 4 3 phản ứng ở 2 thí nghiệm là như nhau. Lượng OH - ở TN2 nhiều hơn ở TN1, lượng kết tủa (y mol) ở TN2 ít hơn ở TN1 (2y mol). Chứng tỏ ở TN2 kết tủa Al OH 3 đã bị hòa tan một phần, ở TN1 kết tủa có thể bị hòa tan hoặc chưa bị hòa tan.
● Nếu ở TN1 kết tủa Al OH 3 chưa bị hòa tan, áp dụng bảo toàn điện tích trong các dung dịch sau phản ứng, ta có :
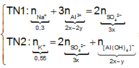
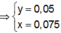
![]() thỏa mãn
thỏa mãn
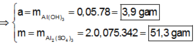
● Ở TN1 kết tủa Al OH 3 đã bị hòa tan, áp dụng bảo toàn điện tích cho dung dịch sau phản ứng, ta có:
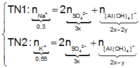
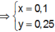
![]() (loại) (*)
(loại) (*)
PS : Nếu không sử dụng biểu thức (*) để biện luận loại trường hợp không thỏa mãn thì sẽ tính ra đáp án B. Nhưng đó là kết quả sai.

Đáp án B
Gọi số mol MgSO4 và Al2(SO4)3 lần lượt là x và y (mol) có trong 200ml dung dịch.
+ 400 ml dd X + NH3 dư => kết tủa thu được là Mg(OH)2 : 2x ( mol) và Al(OH)3: 4y (mol)
=> ∑ mkết tủa = 58.2x + 78.4y = 65,36 (1)
+ 200 ml dd X + Ba(OH)2 dư => kết tủa thu được là Mg(OH)2 : x (mol) và BaSO4 : x + 3y (mol) ( Vì Al(OH)3 tan được trong dd Ba(OH)2 dư)
=> ∑ mkết tủa = 58x + (x + 3y).233 = 151,41 (2)
Từ (1) và (2) => x = 0,16 ; y = 0,15
+ 500 ml dd X ( có 0,4 mol Mg2+, 0,75 mol Al3+) + NaOH→ 70gam kết tủa => lượng NaOH lớn nhất ứng với trường hợp tạo Mg(OH)2↓ và Al(OH)3↓ sau đó kết tủa bị hòa tan 1 phần
=> nAl(OH)3 = (70 – 0,4.58)/78 = 0,6 (mol)
Mg2+ + 2OH → 2Mg(OH)2↓
0,4 → 0,8 (mol)
Al3+ + 3OH-→ Al(OH)3↓
0,75→2,25 → 0,75 (mol)
Al(OH)3+ OH- → AlO2- + 2H2O
(0,75-0,6) → 0,15 (mol)
∑ nOH-= 0,8 + 2,25 + 0,15 = 3,2 (mol) =nNaOH
=> mNaOH = 3,2.40 = 128 (g)

Đáp án A.
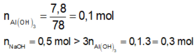
=> xảy ra 2 phản ứng sau:
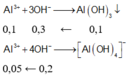
n A l 3 + = 0 , 15 m o l
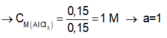

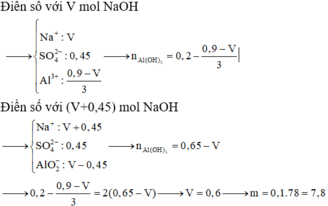

Ta có:
\(\left\{{}\begin{matrix}n_{NaOH}=\frac{300.8\%}{40}=0,6\left(mol\right)\\n_{Al2\left(SO4\right)3}=0,15.1=0,15\left(mol\right)\end{matrix}\right.\)
\(PTHH:Al_2\left(SO_4\right)_3+6NaOH\rightarrow2Al\left(OH\right)_3+3Na_2SO_4\)
Ban đầu:___0,15_______0,6____________
Phứng :____0,1_________0,6_________0,2_______
Sau : ______0,05________0_________0,2____________
\(\Rightarrow m_{Al\left(OH\right)3}=0,2.78=15,6\left(g\right)\)