Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a)%H=100-82,35=17,65g
vì số e lớp ngài cùng là 5 và R thuộc họ p nên R thuộc nhóm VA
-> công thức của R với hidro là RH3
vì hidro chiếm 17, 65% khối lượng-> R chiếm 82,35%
-> MR=0,8235.(MR+3)
-> MR=13,997(g)
-> R là Nitơ (N)
công thức oxit cao nhất của R là N2O5
công thức hidroxit của R là HNO3

a) Oxide cao nhất của hai nguyên tố X và Y khi tan trong nước tạo dung dịch làm giấy quỳ tím chuyển sang màu xanh ⟹ Oxide của X và Y tan trong nước tạo hydroxide có tính base mạnh.
⟹ X và Y là nguyên tố kim loại.
⟹ X và Y có thể là kim loại kiềm hoặc kiềm thổ. Do oxide các nguyên tố này tan trong nước tạo hdroxide mạnh.
b) Tỉ lệ nguyên tử X cũng như Y với oxygen trong các oxide cao nhất là bằng nhau.
⟹ CT oxide của X và Y là: XO, YO.
⟹ X và Y có hóa trị II.
⟹ X và Y thuộc cùng một nhóm IIA.
c) Khối lượng phân tử oxide cao nhất của Y lớn hơn oxide cao nhất của X
⟹ MXO < MYO ⟹ MX < MY
⟹ ZX < ZY

a) X có cấu hình electron lớp ngoài cùng và sát ngoài cùng là: 4s24p65s2.
⟹ Vị trí của X trong bảng tuần hoàn:
- Ô số 38.
- Chu kì 5 do có 5 lớp electron.
- Nhóm IIA do X là nguyên tố họ s, có 2e ở lớp electron ngoài cùng.
b) Tính chất hóa học cơ bản của X:
- X là nguyên tố kim loại vì có 2e ở lớp electron ngoài cùng.
- Kim loại X hoạt động hóa học mạnh.
c) X có hóa trị II
⟹ CTHH của oxide: XO ; CTHH của hydroxide: X(OH)2
d) PTHH khi X tác dụng với Cl2:
X + Cl2 $\xrightarrow{{{t^o}}}$ XCl2

Đáp án D
Nguyên tử của nguyên tố X có cấu hình electron lớp ngoài cùng là ns2np4: Lớp ngoài cùng có 6e
X thuộc nhóm VIA
Hợp chất khí với Hidro của X là: H2X
X chiếm 94,12% khối lượng:
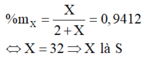
Công thức Oxit cao nhất là SO3
![]()
Câu 1:
Cấu hình e lớp ngoài: ns2np3 → X thuộc nhóm VA.
→ Oxide cao nhất của X: X2O5.
\(\Rightarrow\dfrac{2M_X}{2M_X+16.5}=0,4366\) \(\Rightarrow M_X=31\left(g/mol\right)\)
⇒ X là P.
BTNT P, có: nH3PO4 = 2nP2O5 = 0,3 (mol)
⇒ m = 0,3.98 = 29,4 (g)
Câu 2:
Cấu hình e lớp ngoài: ns2np2 → X thuộc nhóm IVA.
→ Oxide cao nhất: XO2.
\(\Rightarrow\dfrac{M_X}{M_X+16.2}=0,2727\Rightarrow M_X=12\left(g/mol\right)\)
⇒ X là C.
BTNT C: nBaCO3 = nCO2 = 0,2 (mol)
⇒ mBaCO3 = 0,2.197 = 39,4 (g)