Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Câu 2:
\(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\\ n_{H_2}=\dfrac{13,44}{22,4}=0,6\left(mol\right)\\ n_{Al}=\dfrac{2.0,6}{3}=0,4\left(mol\right)\\ \%m_{Al}=\dfrac{0,4.27}{12}.100\%=90\%\Rightarrow\%m_{Ag}=100\%-90\%=10\%\)
Câu 3:
\(n_{H_2}=\dfrac{0,6}{2}=0,3\left(mol\right)\\ 2Al+6HCl\rightarrow2AlCl_3+3H_2\\ Al_2O_3+6HCl\rightarrow2AlCl_3+3H_2O\\ n_{Al}=\dfrac{2}{3}.0,3=0,2\left(mol\right)\\ n_{Al_2O_3}=\dfrac{25,8-0,2.27}{102}=0,2\left(mol\right)\\ n_{AlCl_3}=n_{Al}+2n_{Al_2O_3}=0,2+2.0,2=0,6\left(mol\right)\\ m_{AlCl_3}=133,5.0,6=80,1\left(g\right)\)

Chỉ có Zn phản ứng thôi. Cu không phản ứng, không tan.---->Chất rắn không tan là Cu
Zn+ H2SO4 ---> ZnSO4+ H2↑
0.1 0.1
nH2= 2.24: 22.4=0.1 mol
mZn= 0.1x65=6.5 g
mCu=10.5-6,5=4 g
%Zn=6.5:10.5x100%=61.9%
%Cu=4:10.5x100%=38.1%

Z n + H 2 S O 4 → Z n S O 4 + H 2
Cu không tác dụng với axit Sunfuric.
⇒ n Z n = n H 2 = 2,24/22,4 = 0,1 mol
⇒ m Z n = 0,1.65 = 6,5g
⇒ m C u = m r a n c o n l a i = 10,5 - 6,5 =4g
⇒ Chọn B.

gọi x,y lần lượt là số mol của Fe, Mg:
Fe + CuSO4------> FeSO4 + Cu (1)
x x
Mg + CuSO4 -----> MgSO4 + Cu(2)
y y
a)nCu= 0.69/64=0.01 mol
theo gt, ta có hệ pt: 56x + 24y = 0.51
x + y = 0.01
giải hệ ,ta có x=0.008 , y=0.002
có ncuso4 =>C\(_M\) = (0.008+0.002)/0.1=1M(0.1 là do anh đổi ra lít nha em)
b) mFe=0.008*56=0.448g=> %Fe=0.448*100/0.51\(\approx\)87.84%
tương tự %Cu =12.16%
c) Cu + 2H2SO4 ---> 2H2O + SO2 + CuSO4
0.01 0.01
VSO2= 0.01*22.4=0.224 l
giai xong mệt quá zzzzzz....Chúc em học tốt !!!!!

T gồm : $Cu(x\ mol) ; Ag(2x\ mol) ; Fe$ dư(y mol)
Suy ra: $64x + 108.2x + 56y = 61,6(1)$
$n_{Fe\ pư} = a - y(mol)$
Bảo toàn electron :
$(a- y).2 + 0,25.2 = 2x + 2x(2)$
$2x + 2x + 3y = 0,55.2(3)$
Từ (1)(2)(3) suy ra a = 0,25 ; x = 0,2 ; y = 0,1
T gồm 3 kim loại là Cu (x), Ag (2x) và Fe dư (y)
\(m_T=64x+108\cdot2x+56y=61.6\left(g\right)\left(1\right)\)
Bảo toàn e :
\(2x+2x+3y=0.55\cdot2\left(2\right)\)
\(\left(1\right),\left(2\right):x=0.2,y=0.1\)
Bảo toàn electron:
\(2\cdot\left(a-0.1\right)+0.25\cdot2=2\cdot0.2+0.2\cdot2\)
\(\Rightarrow a=0.25\)
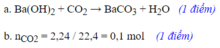

79 c
80a