Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Khi pH = 10 thì [H+] = 1.10-10M và
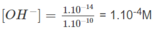
nghĩa là cần có 1. 10 - 4 mol NaOH trong 1 lít dung dịch.
Vậy trong 250 ml (0,25 lít) dung dịch cần có 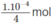 NaOH hoà tan, nghĩa là cần có
NaOH hoà tan, nghĩa là cần có
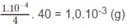 NaOH
NaOH

Ta có: \(pH=14+log\left(OH^-\right)\) \(\Rightarrow log\left(OH^-\right)=-4\)
\(\Rightarrow\left[OH^-\right]=C_{M_{NaOH}}=0,0001\left(M\right)\)
\(\Rightarrow n_{NaOH}=0,0001\cdot0,25=2,5\cdot10^{-5}\left(mol\right)\)
\(\Rightarrow m_{NaOH}=2,5\cdot10^{-5}\cdot40=0,001\left(g\right)\)

pH=12 => 14 + log[OH-]=12
<=>[OH-]=0,01
=> nNaOH=nOH- = 0,5. 0,01= 0,005(mol)
=> mNaOH=0,005.40=0,2(g)
=> CHỌN D
Chúc em học tốt!

Đáp án B
[OH-]= 10-3 (M), nOH-= 0,25.10-3=2,5.10-4 (mol)
Ba(OH)2 → Ba2+ + 2OH-
1,25.10-4 mol 2,5.10-4 mol
mBa(OH)2= 1,25.10-4.171=0,021375 gam

Đáp án D
Gọi thể tích dung dịch NaOH ban đầu là V
Gọi thể tích dung dịch NaOH sau khi pha là V1
Ta có số mol NaOH ko đổi nên
V.10-3 = V1. 10-5 suy ra V1 = 100V tức là pha loãng 100 lần

Gọi V, V’ lần lượt là thể tích dung dịch NaOH có pH = 12, pH = 11
Do pH = 12 → pOH = 2 → [OH-] = 10-2M → nOH-trước khi pha loãng = 10-2V
pH = 11 → pOH = 3 → [OH-] = 10-3M → nOH-sau khi pha loãng = 10-3V’
Ta có nOH-trước khi pha loãng = nOH-sau khi pha loãng → 10-2V = 10-3V’ → V ' V = 10 - 2 10 - 3 = 10
Vậy cần pha loãng dung dịch NaOH 10 lần
Đáp án A

Gọi V, V’ lần lượt là thể tích dung dịch NaOH có pH = 12, pH = 11
Do pH = 12 => pOH = 2 => [OH-] = 10-2M => nOH-trước khi pha loãng = 10-2V
pH = 11 => pOH = 3 => [OH-] = 10-3M => nOH-sau khi pha loãng = 10-3V’
Ta có nOH-trước khi pha loãng = nOH-sau khi pha loãng 10-2V = 10-3V’ => V ' V = 10 - 2 10 - 3 = 10
Vậy cần pha loãng dung dịch NaOH 10 lần
Chọn A.
\(pH=14+log\left[OH^-\right]=10\)
\(\Rightarrow\left[OH^-\right]=10^{-4}\)
\(n_{NaOH}=10^{-4}\cdot0.3=3\cdot10^{-5}\left(mol\right)\)
\(m_{NaOH}=3\cdot10^{-5}\cdot40=1.2\cdot10^{-3}\left(g\right)\)
\([H^+] = 10^{-pH} = 10^{-10} M\\ \Rightarrow C_{M_{NaOH}} = [OH^-] = \dfrac{10^{-14}}{10^{-10}}= 10^{-4}M\\ \Rightarrow n_{NaOH} = 10^{-4}.0,3 = 3.10^{-5}(mol)\\ m_{NaOH} = 3.10^{-5}.40 = 1,2.10^{-3}(gam)\)