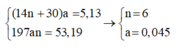Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án C
Hướng dẫn Số mol X là: nX = 2,24/22,4 = 0,1 mol
Khối lượng bình đựng dung dịch axit tăng là khối lượng của H2O:
mH2O = 5,4 gam => nH2O = 5,4/18 = 0,3 mol
Số mol CO2 là: nCO2 = nCaCO3 = 30/100 = 0,3 mol
Nhận thấy: nH2O = nCO2 => hidrocacbon X là anken
Phương trình đốt cháy:
C n H 2 n + 3 n 2 O 2 → n C O 2 + n H 2 O 0 , 1 0 , 3
Ta có: 0,1.n = 0,3 => n = 3. Vậy CTPT của X là C3H6

Đáp án A
Hướng dẫn
Số mol X là: nX = 2,24/22,4 = 0,1 mol
Khối lượng bình đựng dung dịch axit tăng là khối lượng của H2O:
mH2O = 5,4 gam => nH2O = 5,4/18 = 0,3 mol
Số mol CO2 là: nCO2 = nCaCO3 = 30/100 = 0,3 mol
Nhận thấy: nH2O = nCO2 => hidrocacbon X là anken
Phương trình đốt cháy:
C n H 2 n + 3 n 2 O 2 → n C O 2 + n H 2 O 0 , 1 0 , 3
Ta có: 0,1.n = 0,3 => n = 3. Vậy CTPT của X là C3H6

\(m_{H_2O} = m_{bình\ đựng\ axit\ tăng} = 6,3(gam)\\ \Rightarrow n_{H_2O} = \dfrac{6,3}{18} =0,35(mol)\\ CO_2 + Ca(OH)_2 \to CaCO_3 + H_2O\\ n_{CO_2} = n_{CaCO_3} = \dfrac{35}{100} = 0,35(mol)\\ n_X =\dfrac{2,24}{22,4} = 0,1(mol)\\ Vì\ n_{CO_2} = n_{H_2O}\ nên\ CTPT\ của\ X : C_nH_{2n}\\ n = \dfrac{n_{CO_2}}{n_X} = \dfrac{0,35}{0,1} = 3,5\)
Vậy ,CTPT hai hidro cacbon là : \(C_3H_6,C_4H_8\)

nX=0,1 mol
CxHy+\(\left(x+\dfrac{y}{4}\right)\)O2\(\rightarrow\)xCO2+\(\dfrac{y}{2}H_2O\)
- Bình axit bắt H2O: \(m_{H_2O}=5,4g\rightarrow n_{H_2O}=5,4:18=0,3mol\)
- Bình bazo bắt CO2:
CO2+Ca(OH)2\(\rightarrow\)CaCO3+H2O
\(n_{CO_2}=n_{CaCO_3}=\dfrac{30}{100}=0,3mol\)
- Theo PTHH 1 ta có:
x=\(\dfrac{n_{CO_2}}{n_X}=\dfrac{0,3}{0,1}=3\)
\(\dfrac{y}{2}=\dfrac{n_{H_2O}}{n_X}=\dfrac{0,3}{0,1}=3\rightarrow y=6\)
CTPT X: C3H6
- Nếu cho qua bình 2 trước thì bình 2 hấp thụ cả CO2 và H2O nên khối lượng bình 2 tăng: 0,3.44+5,4=18,6g
- Bình 1 hấp thụ H2O nên tăng 5,4 g
- Khối lượng dung dịch bình 2 giảm: 30-18,6=11,4g( do kết tủa tách ra 30g nhiều hơn tổng khối lượng CO2 và H2O là 18,6g)

\(CO_2 + Ca(OH)_2 \to CaCO_3 + H_2O\\ n_{CO_2} = n_{CaCO_3} = \dfrac{3}{100} = 0,03(mol)\\ n_{H_2O} = \dfrac{2,04-0,03.44}{18} = 0,04(mol)\)
Vì \(n_{H_2O} > n_{CO_2}\) nên CTHH của X: CnH2n+2
\(n_X = n_{H_2O} - n_{CO_2} = 0,01(mol)\\ n = \dfrac{n_{CO_2}}{n_X} = \dfrac{0,03}{0,01} = 3\)
Vậy X là C3H8

Đáp án A
Đốt cháy X tạo CO2 và H2O
Bình 1 giữ lại H2O => mH2O = 7,2g => nH = 2nH2O = 0,8 mol
Bình 2 giữ lại CO2 : nCaCO3 = nCO2 = 0,3 mol
Có : mC + mH + mO = mX => nO = 0,1mol
=> nC : nH : nO = 0,3 : 0,8 : 0,1 = 3 : 8 : 1
Vậy CTĐG nhất của X là C3H8O

Đáp án A
Khối lượng bình 1 tăng là khối lượng của H2O => nH2O = 1,8/18 = 0,1 mol
Khối lượng bình 2 tăng là khối lượng của CO2 => nCO2 = 3,52/44 = 0,08 mol
Nhận thấy: nCO2 < nH2O => hidrocacbon là ankan;
Số mol ankan là nankan = 0,1 – 0,08 = 0,02 mol
Phương trình phản ứng:
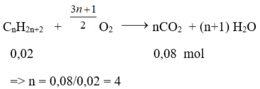
CTPT của A là C4H10