Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

A + H2SO4 → Hỗn hợp khí ⇒ Fe dư; khí Y gồm: H2 ( x mol) và H2S (y mol)
⇒ x + y = 0,1 mol (1)
Bảo toàn S: nH2S = nFeS = nS = y mol
nFe dư = nH2 = x
Bảo toàn Fe: nFe = nFeS + nFe dư = x + y
mX = 56(x + y ) + 32y = 7,2g (2)
Từ (1)(2) ⇒ x = 0,05 mol; y = 0,05 mol
MY = mY : nY = (0,05.2 + 0,05.34) : 0,1 = 18 ⇒ dY/H2 = 9
Gọi \(\left\{{}\begin{matrix}n_{Fe}=a\left(mol\right)\\n_{FeS}=b\left(mol\right)\end{matrix}\right.\left(đk:a,b>0\right)\)
TH1: S dư
Vậy toàn bộ lượng khí sinh ra là H2S
\(d_{Y\text{/}H_2}=d_{H_2S\text{/}H_2}=\dfrac{34}{2}=17\)
TH2: Fe dư
\(n_{khí}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
Bảo toàn KL: \(m_A=m_X=7,2\left(g\right)\)
PTHH:
\(Fe+2HCl\rightarrow FeCl_2+H_2\uparrow\)
a----------------------------->a
\(FeS+2HCl\rightarrow FeCl_2+H_2S\uparrow\)
b-------------------------------->b
Ta có hệ phương trình: \(\left\{{}\begin{matrix}56a+88b=7,2\\a+b=0,1\end{matrix}\right.\)
\(\Leftrightarrow a=b=0,05\left(TM\right)\)
\(M_Y=\dfrac{0,05.\left(2+34\right)}{0,1}=18\left(g\text{/}mol\right)\\ \rightarrow d_{Y\text{/}H_2}=\dfrac{18}{2}=9\)

\(Fe+S\underrightarrow{^{to}}FeS\)
Ta có:
\(n_{Fe}=\frac{5,6}{56}=0,1\left(mol\right)\)
\(n_S=\frac{3,2}{32}=0,1\left(mol\right)\)
Vì số mol hai chất bằng nhau theo đúng tỉ lệ phản ứng nên tính hiệu suất theo chất nào cũng được.
Gọi số mol Fe phản ứng là x
\(\Rightarrow n_{FeS}=n_{Fe\left(pư\right)}=x\left(mol\right);n_{Fe\left(dư\right)}=0,1-x\left(mol\right)\)
\(FeS+2HCl\rightarrow FeCl_2+H_2S\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
\(\Rightarrow n_{H2S}=n_{FeS}=x\left(mol\right),n_{H2}=n_{Fe\left(dư\right)}=0,1-x\left(mol\right)\)
\(\Rightarrow n_Y=x+0,1-x=0,1\left(mol\right)\)
\(\Rightarrow m_Y=34.x+2\left(0,1-x\right)=0,1.10,6.2\)
\(\Rightarrow x=0,06\left(mol\right)\)
\(\Rightarrow H=\frac{0,06}{0,1}=60\%\)

Theo đề bài, sắt còn dư sau khi phản ứng với lưu huỳnh
PTHH: \(Fe+S\underrightarrow{t^o}FeS\) (1)
\(FeS+2HCl\rightarrow FeCl_2+H_2S\uparrow\) (2)
\(Fe+2HCl\rightarrow FeCl_2+H_2\uparrow\) (3)
Ta có: \(n_{hhkhí}=\dfrac{2,688}{22,4}=0,12\left(mol\right)=n_{Fe\left(3\right)}+n_{FeS}=\Sigma n_{Fe}\)
\(\Rightarrow m_{Fe}=0,12\cdot56=6,72\left(g\right)\)

a) Hỗn hợp A gồm FeS (x mol), Fe dư (y mol) và S dư (0,8 gam)
FeS + 2HCl -------> FeCl2 + H2S
x………………..………x…….x (mol)
Fe + 2HCl -------> FeCl2 + H2
y…………………..…y……..y (mol)
=> Khí D gồm H2S và H2
\(M_D=\dfrac{34x+2y}{x+y}=9.2=18\) (*)
Khí D sục rất từ từ qua dung dịch CuCl2
H2S + CuCl2 -------> CuS + 2HCl
x………………………...x (mol)
=>\(n_{CuS}=x=\dfrac{9,6}{96}=0,1\left(mol\right)\)
Từ (*) => y = 0,1 (mol)
nFe = x+ y = 0,1 + 0,1= 0,2 (mol)
=> m = 0,2 .56 = 11,2 (g)
nS pư = x = 0,1 (mol)
=> p = 0,1.32 + 0,8 = 4 (g)
b) Dung dịch C chứa FeCl2
nFeCl2 = x + y = 0,2 (mol)
FeCl2 + 2NaOH -------> Fe(OH)2 + 2NaCl
0,2................................,.0,2 (mol)
4Fe(OH)2 + O2 + 2H2O -------> 4Fe(OH)3
0,2..............................................0,2 (mol)
2Fe(OH)3 ------> Fe2O3 + 3H2O
0,2........................0,1 (mol)
Chất rắn là Fe2O3
Theo PT => nFe2O3 = 0,1 mol
=> mFe2O3 = 0,1.160 = 16 gam

\(n_{Fe}=\dfrac{11,2}{56}=0,2\left(mol\right)\\ n_S=\dfrac{4,8}{32}=0,15\left(mol\right)\)
PTHH: Fe + S --to--> FeS (1)
LTL: \(0,2>0,15\rightarrow\) Fe dư
Theo pthh (1):
\(n_{Fe\left(pư\right)}=n_{FeS}=n_S=0,15\left(mol\right)\\ \rightarrow\left\{{}\begin{matrix}m_{Fe\left(dư\right)}=\left(0,2-0,15\right).56=2,8\left(g\right)\\m_{FeS}=0,15.88=13,2\left(g\right)\end{matrix}\right.\)
PTHH:
FeS + 2HCl ---> FeCl2 + H2S
0,15 0,15
Fe + 2HCl ---> FeCl2 + H2
0,05 0,05
\(\rightarrow M_Z=\dfrac{0,15.34+0,05.2}{0,15+0,05}=26\left(\dfrac{g}{mol}\right)\)
=> dZ/H2 = \(\dfrac{26}{2}=13\)

Đáp án A
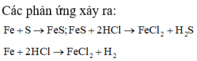
Hỗn hợp khí Z gồm H2S và H2. Đặt nFe=1mol . Dựa vào phương trình phản ứng ta thấy vì số mol khí sinh ra luôn là 1 mol với bất kì hiệu suất và tỉ lệ a:b nào nên:
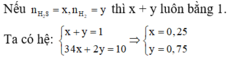
Theo đề bài hiệu suất phản ứng là 50% nhưng do chưa biết Fe hay S dư nên phải xét hai trường hợp. Tuy nhiên khi nhìn vào đáp án có thể thấy số mol sắt lớn hơn số mol lưu huỳnh nên hiệu suất được tính theo lưu huỳnh. Bảo toàn lưu huỳnh suy ra
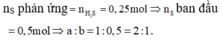
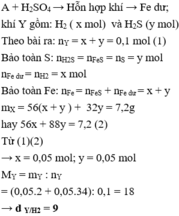
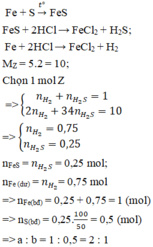
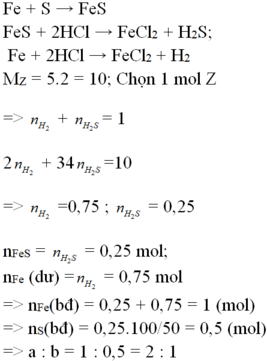
b1
cho m gam hỗn hợp gồm Zn và S vào bình không có không khí ,nung bình sau một thời gian thu được chất
b2
Fe+Sto→FeS
Ta có: nFe=5,6\56=0,1 mol; nS=3,2\32=0,1 moln
VÌ số mol hai chất bằng nhau theo đúng tỉ lệ phản ứng nên tính hiệu suất theo chất nào cũng được.
Gọi số mol Fe phản ứng là x
→nFeS=nFe phản ứng=x mol; nFe dư=0,1−x mol\
FeS+2HCl→FeCl2+H2S\
Fe+2HCl→FeCl2+H2\
→nH2S=nFeS=x mol; nH2=nFe dư=0,1−x mol\
→nY=x+0,1−x=0,1 mol; mY=34.x+2.(0,1−x)=0,1.10,6.2→x=0,06 mol
Hiệu suất phản ứng: H=0,06\0,1=60%