
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Anh sửa lại chút nha !
\(n_{CO_2}=n_{H_2SO_4}+\dfrac{1}{2}\cdot n_{HCl}=0.4\left(mol\right)\)
\(\Rightarrow n_{HCl}=\left(0.4-0.3\right)\cdot2=0.2\left(mol\right)\)
\(C_{M_{HCl}}=\dfrac{0.2\cdot2}{0.01}=40\left(M\right)\)
\(C_{M_{H_2SO_4}}=\dfrac{0.3\cdot2}{0.01}=60\left(M\right)\)
P1 :
\(BaCl_2+H_2SO_4\rightarrow BaSO_4+2HCl\)
\(n_{BaSO_4}=n_{H_2SO_4}=\dfrac{6.99}{233}=0.3\left(mol\right)\)
P2 :
\(Na_2CO_3+H_2SO_4\rightarrow Na_2SO_4+CO_2+H_2O\)
\(Na_2CO_3+2HCl\rightarrow2NaCl+CO_2+H_2O\)
\(n_{HCl}=0.4-0.3=0.1\left(mol\right)\)
\(C_{M_{HCl}}=\dfrac{0.1\cdot2}{0.01}=20\left(M\right)\)
\(C_{M_{H_2SO_4}}=\dfrac{0.3\cdot2}{0.01}=60\left(M\right)\)

Câu 3:
\(n_{CuO}=\dfrac{6,4}{80}=0,08(mol)\\ n_{HCl}=\dfrac{36,5.20}{100.36,5}=0,2(mol)\\ CuO+2HCl\to CuCl_2+H_2\\ \dfrac{n_{CuO}}{1}<\dfrac{n_{HCl}}{2}\Rightarrow HCl\text{ dư}\\ \Rightarrow n_{HCl(dư)}=0,2-0,08.2=0,04(mol)\\ n_{CuCl_2}=n_{H_2}=0,08(mol);n_{HCl(p/ứ)}=0,16(mol)\\ \Rightarrow C\%_{CuCl_2}=\dfrac{0,08.135}{6,4+36,5-0,08.2}.100\%=25,27\%\\ C\%_{HCl(dư)}=\dfrac{0,04.36,5}{6,4+36,5-0,08.2}.100\%=3,42\%\)


a) $KOH,Ba(OH)_2$
b)
$2Al(OH)_3 + 3H_2SO_4 \to Al_2(SO_4)_3 + 6H_2O$
$Fe(OH)_2 + H_2SO_4 \to FeSO_4 + 2H_2O$
$2Fe(OH)_3 + 3H_2SO_4 \to Fe_2(SO_4)_3 + 6H_2O$
$2KOH + H_2SO_4 \to K_2SO_4+ 2H_2O$
$Cu(OH)_2 + H_2SO_4 \to CuSO_4 + 2H_2O$
$Ba(OH)_2 + H_2SO_4 \to BaSO_4 + 2H_2O$
c)
$2KOH + SO_2 \to K_2SO_3 + H_2O$
$Ba(OH)_2 + SO_2 \to BaSO_3 + H_2O$
d)
$CuSO_4 + 2KOH \to Cu(OH)_2 + K_2SO_4$
$CuSO_4 + Ba(OH)_2 \to BaSO_4 + Cu(OH)_2$
e)
$2Al(OH)_3 \xrightarrow{t^o} Al_2O_3 + 3H_2O$
$Fe(OH)_2 \xrightarrow{t^o} FeO + H_2O$
$2Fe(OH)_3 \xrightarrow{t^o} Fe_2O_3 + 3H_2O$
$Cu(OH)_2 \xrightarrow{t^o} CuO + H_2O$
Bài 4:
\(a.\)
Chất làm quỳ tím hóa xanh : KOH , Ba(OH)2
\(b.\)
\(2Al\left(OH\right)_3+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2O\)
\(Fe\left(OH\right)_2+H_2SO_4\rightarrow FeSO_4+2H_2O\)
\(2Fe\left(OH\right)_3+3H_2SO_4\rightarrow Fe_2\left(SO_4\right)_3+3H_2O\)
\(KOH+H_2SO_4\rightarrow K_2SO_4+H_2O\)
\(Cu\left(OH\right)_2+H_2SO_4\rightarrow CuSO_4+2H_2O\)
\(Ba\left(OH\right)_2+H_2SO_4\rightarrow BaSO_4+2H_2O\)
\(c.\)
\(2KOH+SO_2\rightarrow K_2SO_3+H_2O\)
\(Ba\left(OH\right)_2+SO_2\rightarrow BaSO_3+H_2O\)
\(d.\)
\(2KOH+CuSO_4\rightarrow Cu\left(OH\right)_2+K_2SO_4\)
\(Ba\left(OH\right)_2+CuSO_4\rightarrow BaSO_4+Cu\left(OH\right)_2\)
\(e.\)
\(2Al\left(OH\right)_3\underrightarrow{^{^{t^0}}}Al_2O_3+3H_2O\)
\(2Fe\left(OH\right)_3\underrightarrow{^{^{t^0}}}Fe_2O_3+3H_2O\)
\(4Fe\left(OH\right)_2+O_2\underrightarrow{^{^{t^0}}}2Fe_2O_3+4H_2O\)
\(Cu\left(OH\right)_2\underrightarrow{^{^{t^0}}}CuO+H_2O\)

a) Đặt CT là \(Na^I_xO^{II}_y\left(x,y:nguyên,dương\right)\)
Theo quy tắc hóa trị, ta có:
\(I.x=II.y\\ \Leftrightarrow\dfrac{x}{y}=\dfrac{II}{I}=\dfrac{2}{1}\\ \Rightarrow x=2;y=1\)
=> CTHH cần tìm Na2O
b)
Đặt CT là \(C^{IV}_xS^{II}_y\left(x,y:nguyên,dương\right)\)
Theo quy tắc hóa trị, ta có:
\(IV.x=II.y\\ \Leftrightarrow\dfrac{x}{y}=\dfrac{II}{IV}=\dfrac{2}{4}=\dfrac{1}{2}\\ \Rightarrow x=1;y=2\)
=> CTHH cần tìm là CS2
c)
Đặt CT là \(Ca^{II}_x\left(NO_3\right)^I_y\left(x,y:nguyên,dương\right)\)
Theo quy tắc hóa trị, ta có:
\(II.x=I.y\\ \Leftrightarrow\dfrac{x}{y}=\dfrac{I}{II}=\dfrac{1}{2}\\ \Rightarrow x=1;y=2\)
-> CTHH là Ca(NO3)2
d)
Đặt CT là \(Ba^{II}_x\left(SO_4\right)^{II}_y\left(x,y:nguyên,dương\right)\)
Theo quy tắc hóa trị, ta có:
\(II.x=II.y\\ \Leftrightarrow\dfrac{x}{y}=\dfrac{II}{II}=\dfrac{2}{2}=\dfrac{1}{1}\\ \Rightarrow x=1;y=1\)
=> CTHH cần tìm là BaSO4

(1) \(CaC_2+2H_2O\rightarrow C_2H_2+Ca\left(OH\right)_2\)
(2) \(C_2H_2+2Br_2\rightarrow C_2H_2Br_4\)





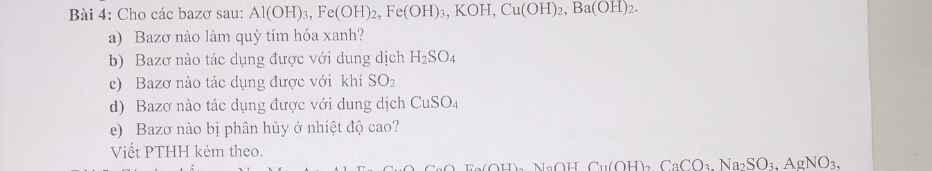


 giúp mik với ạ
giúp mik với ạ
a)
$Fe + H_2SO_4 \to FeSO_4 + H_2$
CT tinh thể: FeSO4.7H2O
b)
Không thể thay bằng H2SO4 60% vì với nồng độ như vậy là axit đặc nên oxi hóa Fe lên hóa trị cao nhất(hóa trị III) nên không thể tạo tinh thể FeSO4.7H2O
Cần bay hơi trong khí quyển CO2 mà không phải trong không khí vì :
$2FeSO_4 + \dfrac{1}{2}O_2 + H_2SO_4 \to Fe_2(SO_4)_3 + H_2O$
câu 3 nha mn