Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

pH=12 => 14 + log[OH-]=12
<=>[OH-]=0,01
=> nNaOH=nOH- = 0,5. 0,01= 0,005(mol)
=> mNaOH=0,005.40=0,2(g)
=> CHỌN D
Chúc em học tốt!

a, \(n_{H^+}=0,025.0,2=0,005\left(mol\right)\)
\(n_{OH^-}=0,01.2.0,3=0,006\left(mol\right)\)
\(\Rightarrow n_{OH^-dư}=0,001\left(mol\right)\)
\(\Rightarrow\left[OH^-\right]_{dư}=\dfrac{0,001}{1}=10^{-3}\)
\(\Rightarrow\left[H^+\right]=10^{-11}\)
\(\Rightarrow pH=11\)
b, \(n_{Fe^{2+}}=n_{SO_4^{2-}}=0,02.0,1=0,002\left(mol\right)\)
\(n_{Ba^{2+}}=0,01.0,3=0,003\left(mol\right)\)
\(\Rightarrow\left\{{}\begin{matrix}n_{BaSO_4\downarrow}=n_{SO_4^{2-}}=0,002\left(mol\right)\\n_{Fe\left(OH\right)_2\downarrow}=n_{OH^-dư}=0,001\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow m_{\downarrow}=0,002.233+0,001.90=0,556\left(g\right)\)

Đáp án D
Trong 100ml dd X có :
+ nCO32- = nCO2 = 0,1
+ Lấy 100 ml dung dịch X cho tác dụng với lượng dư dung dịch BaCl2 thấy có 43 gam kết tủa
⇒ mBaCO3 + mBaSO4 = 43 ⇒ mBaSO4 = 43 – 0,1.197 = 23,3g
⇒ nSO42- = 0,1
+ nNH4+ =nNH3 = 0,2
Bảo toàn điện tích ⇒ nNa+ = 0,2
⇒ Trong 500ml ddX có mmuối =5.(0,1.60 + 0,1.96 + 0,2.18 + 0,2.23) = 119g
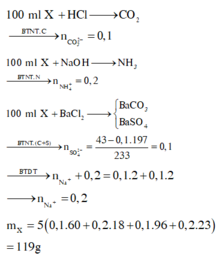

a)
\(\begin{array}{l}{{\rm{n}}_{{\rm{HCl}}}}{\rm{ = 0}}{\rm{,5}}{\rm{.0}}{\rm{,2 = 0}}{\rm{,1 (mol)}}\\{{\rm{V}}_{{\rm{dd}}}}{\rm{ = 0}}{\rm{,5 + 0}}{\rm{,5 = 1 (l)}}\\ \Rightarrow {\rm{(HCl) = }}\frac{{{\rm{0}}{\rm{,1}}}}{{\rm{1}}}{\rm{ = 0}}{\rm{,1 (M)}}\\{\rm{HCl}} \to {{\rm{H}}^{\rm{ + }}}{\rm{ + C}}{{\rm{l}}^{\rm{ - }}}\\{\rm{0}}{\rm{,1}} \to {\rm{ 0}}{\rm{,1}}\\ \Rightarrow {\rm{(}}{{\rm{H}}^{\rm{ + }}}{\rm{) = (HCl) = 0}}{\rm{,1 (M)}}\end{array}\)
\( \Rightarrow \) pH = -lg(0,1) = 1
b)
\(\begin{array}{l}{\rm{pH = 12}} \Rightarrow {\rm{(}}{{\rm{H}}^{\rm{ + }}}{\rm{) = 1}}{{\rm{0}}^{{\rm{ - 12}}}}{\rm{(M)}}\\ \Rightarrow {\rm{(O}}{{\rm{H}}^{\rm{ - }}}{\rm{) = }}\frac{{{\rm{1}}{{\rm{0}}^{{\rm{ - 14}}}}}}{{{\rm{1}}{{\rm{0}}^{{\rm{ - 12}}}}}}{\rm{ = 1}}{{\rm{0}}^{{\rm{ - 2}}}}{\rm{(M)}}\\{\rm{NaOH}} \to {\rm{N}}{{\rm{a}}^{\rm{ + }}}{\rm{ + O}}{{\rm{H}}^{\rm{ - }}}\\{10^{ - 2}} \leftarrow {\rm{ }}{10^{ - 2}}\\ \Rightarrow {\rm{(NaOH) = (O}}{{\rm{H}}^{\rm{ - }}}{\rm{) = 1}}{{\rm{0}}^{{\rm{ - 2}}}}{\rm{(M)}}\\ \Rightarrow {{\rm{n}}_{{\rm{NaOH}}}}{\rm{ = 1}}{{\rm{0}}^{{\rm{ - 2}}}}{\rm{.0}}{\rm{,1 = 1}}{{\rm{0}}^{{\rm{ - 3}}}}{\rm{(mol)}}\\ \Rightarrow {{\rm{m}}_{{\rm{NaOH}}}}{\rm{ = 1}}{{\rm{0}}^{{\rm{ - 3}}}}{\rm{.40 = 0}}{\rm{,04(g)}}\end{array}\)