Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Gọi: \(\left\{{}\begin{matrix}n_{Al}=x\left(mol\right)\\n_{Fe}=y\left(mol\right)\end{matrix}\right.\) ⇒ 27x + 56y = 5,5 (1)
PT: \(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
Theo PT: \(n_{H_2}=\dfrac{3}{2}n_{Al}+n_{Fe}=\dfrac{3}{2}x+y=\dfrac{4,48}{22,4}=0,2\left(mol\right)\left(2\right)\)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}x=0,1\left(mol\right)\\y=0,05\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{Al}=\dfrac{0,1.27}{5,5}.100\%\approx49,09\%\\\%m_{Fe}\approx50,91\%\end{matrix}\right.\)

Gọi \(\left\{{}\begin{matrix}n_{Al}=x\left(mol\right)\\n_{Fe}=y\left(mol\right)\end{matrix}\right.\)
\(n_{H_2}=\dfrac{4,48}{22,4}=0,2mol\)
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
Theo pt: \(\Rightarrow\left\{{}\begin{matrix}3x+y=0,2\\27x+56y=5,5\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}x=\dfrac{19}{470}\\y=\dfrac{37}{470}\end{matrix}\right.\)
\(\%m_{Al}=\dfrac{\dfrac{19}{470}\cdot27}{5,5}\cdot100\%=19,84\%\)
\(\%m_{Fe}=100\%-19,84\%=80,16\%\)

a.
\(m_{Ag}=m_{k.tan}=8,7\left(g\right)\\ m_{Zn,Mg}=20-8,7=11,3\left(g\right)\\ \left\{{}\begin{matrix}n_{Zn}=a\left(mol\right)\\n_{Mg}=b\left(mol\right)\end{matrix}\right.\left(a,b>0\right)\\Zn+H_2SO_4\rightarrow ZnSO_4+H_2\\ Mg+H_2SO_4\rightarrow MgSO_4+H_2\\ \rightarrow\left\{{}\begin{matrix}65a+24b=11,3\\a+b=0,3\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}a=0,1\\b=0,2\end{matrix}\right.\)
\(\left\{{}\begin{matrix}\%m_{Ag}=\dfrac{8,7}{20}.100=43,5\%\\\%m_{Mg}=\dfrac{24.0,2}{20}.100=24\%\\\%m_{Zn}=\dfrac{0,1.65}{20}.100=32,5\%\end{matrix}\right.\)
b.
\(n_{H_2SO_4\left(tổng\right)}=a+b=0,3\left(mol\right)\\ V_{ddH_2SO_4\left(tổng\right)}=\dfrac{0,3}{0,5}=0,6\left(lít\right)=600\left(ml\right)\)

\(n_{H_2}=\dfrac{5,6}{22,4}=0,25\left(mol\right)\)
a.
\(A+2HCl\rightarrow ACl_2+H_2\)
0,25 0,5 0,25 0,25
=> \(M_A=\dfrac{16,25}{0,25}=65\)
Vậy kim loại A là Zn.
b.
\(m_{dd.HCl}=\dfrac{0,5.36,5.100}{18,25}=100\left(g\right)\)
c.
\(V_{dd.HCl}=\dfrac{m_{dd.HCl}}{D_{dd.HCl}}=\dfrac{100}{1,2}=83\left(ml\right)\)
Đổi: 83 ml = 0,083 (l)
\(CM_{dd.HCl}=\dfrac{0,5}{0,083}=6M\)
(Nếu V không đổi thì mới tính được CM dd muối sau pứ, còn đề không nói thì mình cũng không biết nữa).

a) n H2 = 15,68/22,4 = 0,7(mol)
$Zn + 2HCl \to ZnCl_2 + H_2$
$Fe + 2HCl \to FeCl_2 + H_2$
Theo PTHH : nHCl = 2n H2 = 1,4(mol)
=> CM HCl = 1,4/2 = 0,7M
b) n Zn = a(mol) ; n Fe = b(mol) => 65a + 56b = 43,7(1)
n H2 = a + b = 0,7(2)
Từ (1)(2) suy ra a = 0,5 ; b = 0,2
Suy ra:
m Zn = 0,5.65 = 32,5 gam
m Fe = 0,2.56 = 11,2 gam
a) n H2 = 15,68/22,4 = 0,7(mol)
Zn+2HCl→ZnCl2+H2Zn+2HCl→ZnCl2+H2
Fe+2HCl→FeCl2+H2Fe+2HCl→FeCl2+H2
Theo PTHH : nHCl = 2n H2 = 1,4(mol)
=> CM HCl = 1,4/2 = 0,7M
b) n Zn = a(mol) ; n Fe = b(mol) => 65a + 56b = 43,7(1)
n H2 = a + b = 0,7(2)
Từ (1)(2) suy ra a = 0,5 ; b = 0,2
Suy ra:
m Zn = 0,5.65 = 32,5 gam
m Fe = 0,2.56 = 11,2 gam

a)
Fe +2 HCl --> FeCl2+ H2
R + 2HCl --> RCl2 + H2
nhh = nH2= 0,672/22,3=0,03 mol
=> M trung bình =1,52/ 0,03= 50,6
Vì MFe=56> Mtb => R<50,6
nH2SO4= 49.8%/98= 0,04 mol
R + H2SO4 --> RSO4 +H2
axit dư => nR phản ứng = nH2SO4 phản ứng <0,04
=> R>1,52/0,04= 38
Suy ra 38< R< 50,6, R hóa trị II
Vậy R là Canxi (Ca) . R =40
b)
Có nFe +nCa= 0,03mol
m hh=56nFe +40nCa =1,52
=> n Fe = 0,02 mol ; n Ca = 0,01 mol
=> %mFe, %mCa
c)
nHCl = 2nH2 =0,06 mol
=> mddHCl =36,5.0,06.100/15=14,6g
mddB= m hhkl + m ddHCl - mH2 = 1,52+ 14,6 -0,03.2= 16,06 g
dd B có FeCl2 0,02 mol và CaCl2 0,01 mol
=> C%.

Hòa tan 1,52g hh Fe và kim loại R có hóa trị II trong dd HCl 15% vừa đủ thu được 0,672lit khí (đktc) và dd B. Nếu hòa tan 1,52g kim loại R trong 49g dd H2SO4 8% thì lượng axit còn dư
a) xác định kl A
==========
Fe +2 HCl --> FeCl2+ H2
R + 2HCl --> RCl2 + H2
nhh = nH2= 0,672/22,3=0,03 mol
=> M trung bình =1,52/ 0,03= 50,6
Vì MFe=56> Mtb => R<50,6
nH2SO4= 49.8%/98= 0,04 mol
R + H2SO4 --> RSO4 +H2
axit dư => nR phản ứng = nH2SO4 phản ứng <0,04
=> R>1,52/0,04= 38
Suy ra 38< R< 50,6, R hóa trị II
Vậy R là Canxi (Ca) . R =40
Có nFe +nCa= 0,03mol
m hh=56nFe +40nCa =1,52
=> n Fe = 0,02 mol ; n Ca = 0,01 mol
=> %mFe, %mCa
c) tính nồng độ phần trăm của các chất trong dd B
nHCl = 2nH2 =0,06 mol
=> mddHCl =36,5.0,06.100/15=14,6g
mddB= m hhkl + m ddHCl - mH2 = 1,52+ 14,6 -0,03.2= 16,06 g
dd B có FeCl2 0,02 mol và CaCl2 0,01 mol
=> C%=bạn tự làm nha

a) Gọi số mol Al, Mg là a, b
=> 27a + 24b = 6,3
PTHH: 2Al + 6HCl --> 2AlCl3 + 3H2
a------------------------->1,5a
Mg + 2HCl --> MgCl2 + H2
b--------------------------->b
=> \(1,5a+b=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
=> a = 0,1; b = 0,15
=> \(\left\{{}\begin{matrix}m_{Al}=0,1.27=2,7\left(g\right)\\m_{Mg}=0,15.24=3,6\left(g\right)\end{matrix}\right.\)
b)
PTHH: MxOy + yH2 --to--> xM + yH2O
\(\dfrac{0,3}{y}\)<--0,3
=> \(M_{M_xO_y}=x.M_M+16y=\dfrac{17,4}{\dfrac{0,3}{y}}\)
=> \(M_M=21.\dfrac{2y}{x}\left(g/mol\right)\)
Xét \(\dfrac{2y}{x}=1\) => Loại
Xét \(\dfrac{2y}{x}=2\) => Loại
Xét \(\dfrac{2y}{x}=3\) => Loại
Xét \(\dfrac{2y}{x}=\dfrac{8}{3}\) => MM = 56 (g/mol) => M là Fe
a, ptpứ:
\(Mg+2HCl\rightarrow MgCl_2+H_2\left(1\right)\)
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\left(2\right)\)
gọi số mol Mg là x mol , số mol Al là y mol ( x; y >0)
ta có pt : \(24x+27y=6,3\left(3\right)\)
theo bài : \(nH_2=0,3mol\)
theo ptpư(1) \(nH_2=nMg=xmol\)
theo ptpư(2) \(nH_2=\dfrac{3}{2}nAl=\dfrac{3}{2}ymol\)
tiếp tục có pt : \(x+\dfrac{3}{2}y=0,3\left(4\right)\)
từ (3) và (4) ta có hệ pt:
\(24x+27y=6,3\\ x+\dfrac{3}{2}y=0,3\)
<=> \(x=0,15\) ; \(y=0,1\)
\(mMg=24x=24.0,15=3,6gam\)
\(mAl=27y=27.0,1=2,7gam\)
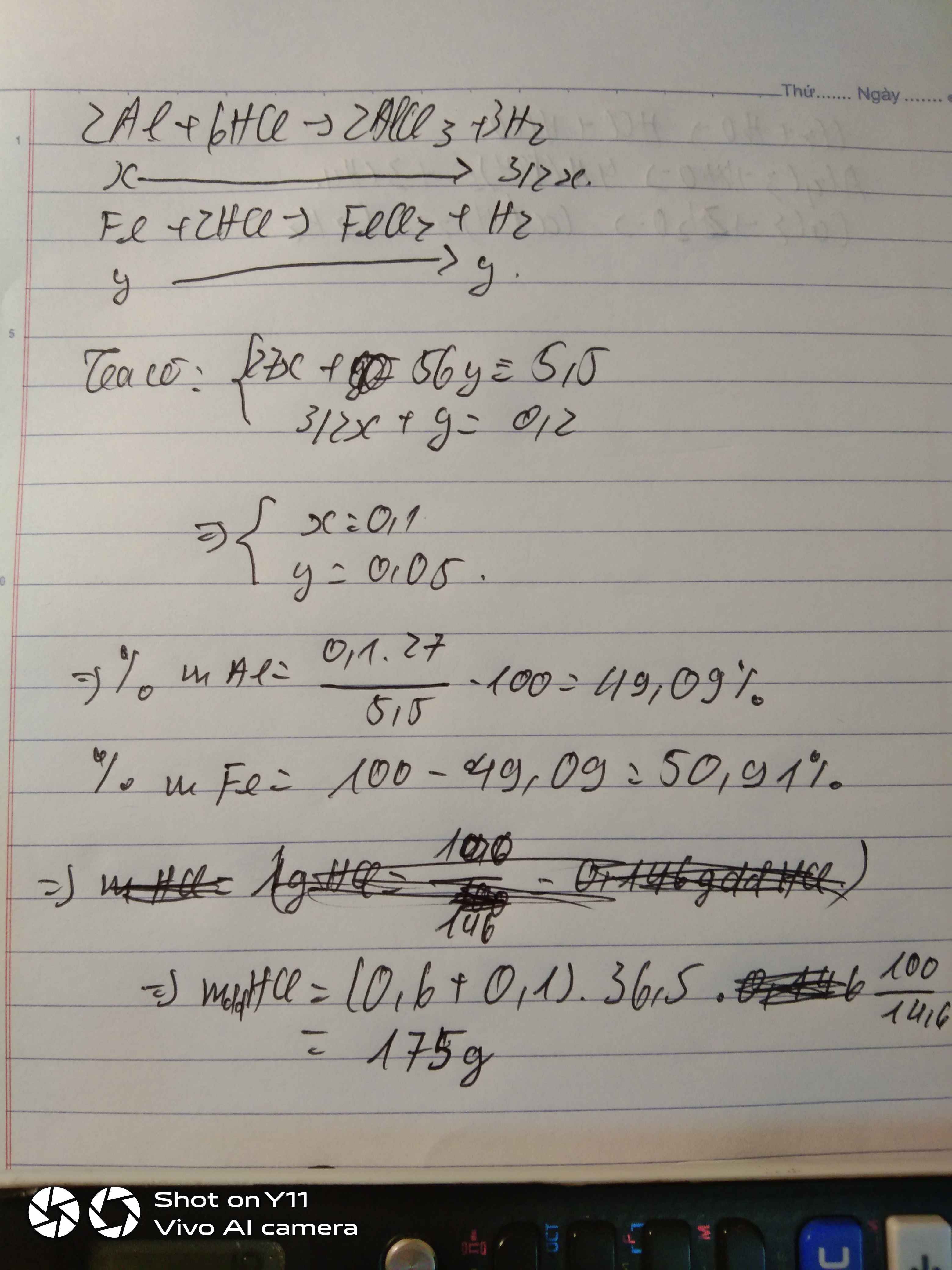

\(a.n_{H_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\\ 2Al+6HCl\rightarrow2AlCl_3+3H_2\\ a............3a.......a.........1,5a\left(mol\right)\\ Fe+2HCl\rightarrow FeCl_2+H_2\\ b.........2b........b.........b\left(mol\right)\\ \rightarrow\left\{{}\begin{matrix}27a+56b=5,5\\1,5a+b=0,2\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}a=0,1\\b=0,05\end{matrix}\right.\\ \rightarrow\left\{{}\begin{matrix}\%m_{Al}=\dfrac{27.0,1}{5,5}.100\approx49,091\%\\\%m_{Fe}=\dfrac{0,05.56}{5,5}.100\approx50,909\%\end{matrix}\right.\\ b.C_{MddHCl}=\dfrac{3a+2b}{0,5}=\dfrac{3.0,1+2.0,05}{0,5}=0,8\left(M\right)\)
giúp mình bài 20 vs