Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

nNO=\(\dfrac{1.12}{22.4}=0.05(mol)\)
Gọi nAl=a(mol)
.....nFe=b(mol)
Ta có 27a + 56b = 2.22(g) (*)
Quá trình cho e
Al0.................➞ Al+3 + 3e
a......................................3a(mol)
Fe0.................➞ Fe+3 + 3e
b......................................3b(mol)
Quá trình nhận e
N+5 + 3e ➞..N+2
.........0.15.....0.05 (mol)
Áp dụng định luật bảo toàn electron ta có
3a + 3b = 0.15(**)
Giải (*) và (**) ta được a=0.02(mol),b=0.03(mol)
%Al=\(\dfrac{0.02*27}{2.22}*100\)%=24.324%
%Fe=100%-24.324%=75.676%
b) bạn tự làm nhé

a, nNO=1.1222.4=0.05(mol)1.1222.4=0.05(mol)
Gọi nAl=a(mol)
.....nFe=b(mol)
Ta có 27a + 56b = 2.22(g) (*)
Quá trình cho e
AlO.................➞ Al+3 + 3e
a......................................3a(mol)
FeO.................➞ Fe+3 + 3e
b......................................3b(mol)
Quá trình nhận e
N+5 + 3e ➞..N+2
.........0.15.....0.05 (mol)
Áp dụng định luật bảo toàn electron ta có
3a + 3b = 0.15(**)
Giải (*) và (**) ta được a=0.02(mol),b=0.03(mol)
%Al=0.02∗272.22∗1000.02∗272.22∗100%=24.324%
%Fe=100%-24.324%=75.676%
b, ddA chứa: Al3+ 0.02 mol, Fe3+ 0.03 mol, HNO3 dư 0.05 mol => số mol ion dương = 0.2 mol
nNaOH = nOH- = 0.21 mol > 0.2 mol. Vậy OH- dư, nOH- dư = 0.21 - 0.2 = 0.01 mol
Fe(OH)3 kết tủa trước vì Fe(OH)3 có tích số tan lớn hơn nhiều Al(OH)3.
Fe3+ + 3OH- ---> Fe(OH)3
nFe(OH)3 = nFe3+ = 0.03 mol
Al3+ + 3OH- ---> Al(OH)3 (1)
nAl(OH)3 (1) = nAl3+ = 0.02 mol
Al(OH)3 + OH- ---> (AlO2)- + 2H2O
nOH- = 0.01 mol => nAl(OH)3 tan = 0.01 mol => nAl(OH)3 còn lại = 0.02 - 0.01 = 0.01 mol
Chất rắn còn lại: Fe(OH)3 0.03 mol, Al(OH)3 0.01 mol
2Fe(OH)3 ---> Fe2O3 + 3H2O...........2Al(OH)3 ---> Al2O3 + 3H2O
0.03.................0.015...............
m (oxit) = 0.015 x 160 + 0.005 x 102 = 2.91g

Em tham khảo nhé !
Đặt nAl = a và nFe = b
—> 27a + 56b = 3,28 (1)
nHCl = 0,5 và nNaOH = 0,65
—> nNaCl = 0,5
TH1: Nếu kết tủa vẫn còn Al(OH)3 —> nNaAlO2 = 0,65 – 0,5 = 0,15
Kết tủa gồm Fe(OH)2 (b) và Al(OH)3 (a – 0,15)
Nung ngoài không khí —> Al2O3 (a – 0,15)/2 và Fe2O3 (b/2)
m rắn = 102(a – 0,15)/2 + 160b/2 = 1,6 (2)
(1)(2) —> Vô nghiệm, loại
TH2: Kết tủa chỉ có Fe(OH)2 (b mol)
—> m rắn = 160b/2 = 1,6 (3)
(1)(3) —> a = 0,08 và b = 0,02
—> %Al = 65,85% và %Fe = 34,15%

Gọi số mol Al, Fe là a, b (mol)
=> 27a + 56b = 2,22 (1)
\(n_{HNO_3}=0,5.0,5=0,25\left(mol\right)\)
\(n_{NO}=\dfrac{1,12}{22,4}=0,05\left(mol\right)\)
Có nHNO3 > 4.nNO => HNO3 dư
PTHH: \(Al+4HNO_3\rightarrow Al\left(NO_3\right)_3+NO+2H_2O\)
_______a------>4a------------->a----------->a____________(mol)
\(Fe+4HNO_3\rightarrow Fe\left(NO_3\right)_3+NO+H_2O\)
_b------>4b------------>b------------>b__________________(mol)
=> a + b = 0,05 (2)
(1)(2) => \(\left\{{}\begin{matrix}a=0,02\left(mol\right)\\b=0,03\left(mol\right)\end{matrix}\right.\)
=> A \(\left\{{}\begin{matrix}n_{Al\left(NO_3\right)_3}=0,02\left(mol\right)\\n_{Fe\left(NO_3\right)_3}=0,03\left(mol\right)\\n_{HNO_3\left(dư\right)}=0,05\left(mol\right)\end{matrix}\right.\)
\(n_{NaOH}=1.0,21=0,21\left(mol\right)\)
PTHH: \(HNO_3+NaOH\rightarrow NaNO_3+H_2O\)
_______0,05------->0,05_______________________(mol)
\(Fe\left(NO_3\right)_3+3NaOH\rightarrow Fe\left(OH\right)_3\downarrow+3NaNO_3\)
__0,03---------->0,09---------->0,03_______________(mol)
\(Al\left(NO_3\right)_3+3NaOH\rightarrow3NaNO_3+Al\left(OH\right)_3\downarrow\)
_-0,02----------->0,06------------------------->0,02_____(mol)
\(2Fe\left(OH\right)_3\underrightarrow{t^o}Fe_2O_3+3H_2O\)
__0,03-------->0,015__________________(mol)
\(2Al\left(OH\right)_3\underrightarrow{t^o}Al_2O_3+3H_2O\)
__0,02-------->0,01___________________(mol)
=> \(m_{rắn}=0,015.160+0,01.102=3,42\left(g\right)\)

Pư: Mg+2HCl -> MgCl2 +H2
MgO+2HCl-> MgCl2 +H2O
MgCl2+2NaOH-> Mg(OH)2↓+2NaCl
Mg(OH)2-> MgO+H2O
nMgO=14/40=0.35 mol
-> nMg(OH)2=nMgCl2=nMgO=0.35 mol
-> nMgO=nMg=nMgCl2=0.35 mol
gọi x,y lần lượt là số mol của Mg,MgO
->mhh=24x+40y=2 (1)
nMgCl2=x+y=0.35 (2)
giải hệ (1)(2) có x=0.103125
y=0.246875
- khối lượng của bạn nhập sai vì klg hỗn hợp quá nhỏ
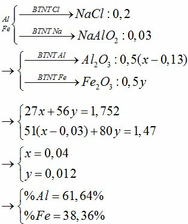



NO3- + 4H+ + 3e ---> NO + 2H2O
nNO = 1.12 / 22.4 = 0.05 mol => nH+ = nHNO3pư = 0.2 mol
nHNO3 đầu = CV = 0.5 x 0.5 = 0.25 mol > 0.2 mol
Vậy HNO3 dư và Al, Fe tan hết. nHNO3 dư = 0.25 - 0.2 = 0.05 mol
Đặt x = nAl, y = nFe: => 27x + 56y = 2.22g
Al - 3e ---> Al3+ và Fe - 3e ---> Fe3+
x.....3x.....................y......3y
=> ne cho = 3x + 3y (mol) => nNO = x + y = 0.05 mol
Giải hệ: x = 0.02 mol; y = 0.03 mol
=> %Al = 0.02 x 27 x 100 / 2.22 = 24.3244% => %Fe = 75.6757%
ddA chứa: Al3+ 0.02 mol, Fe3+ 0.03 mol, HNO3 dư 0.05 mol => số mol ion dương = 0.2 mol
nNaOH = nOH- = 0.21 mol > 0.2 mol. Vậy OH- dư, nOH- dư = 0.21 - 0.2 = 0.01 mol
Fe(OH)3 kết tủa trước vì Fe(OH)3 có tích số tan lớn hơn nhiều Al(OH)3.
Fe3+ + 3OH- ---> Fe(OH)3
nFe(OH)3 = nFe3+ = 0.03 mol
Al3+ + 3OH- ---> Al(OH)3 (1)
nAl(OH)3 (1) = nAl3+ = 0.02 mol
Al(OH)3 + OH- ---> (AlO2)- + 2H2O
nOH- = 0.01 mol => nAl(OH)3 tan = 0.01 mol => nAl(OH)3 còn lại = 0.02 - 0.01 = 0.01 mol
Chất rắn còn lại: Fe(OH)3 0.03 mol, Al(OH)3 0.01 mol
2Fe(OH)3 ---> Fe2O3 + 3H2O...........2Al(OH)3 ---> Al2O3 + 3H2O
0.03.................0.015...............
m (oxit) = 0.015 x 160 + 0.005 x 102 = 2.91g
đừng lấy câu trả lời của người khác và biến nó thành của mình