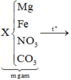
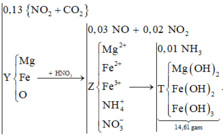
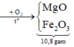
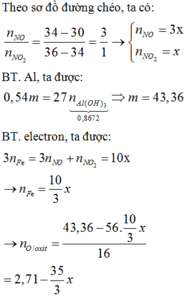1. Nung m gam hỗn hợp gồm Fe(NO3)2 và CuS trong bình kín chân không. Sau khi các pư xảy ra hoàn toàn, thu được chất rắn Y và 14,56 lít hỗn hợp khí Z (đktc). Chất rắn Y tác dụng vừa đủ với 500 ml dd H2SO4 nồng độ a mol/l, thu được dd A và còn lại 4,8 gam chất rắn. Tìm m và a.
2.
Đốt cháy hoàn toàn 4,4 gam sunfua của kim loại M (có công thức MS) trong oxi dư. Chất rắn sau phản ứng đem hòa tan trong một lượng vừa đủ dd HNO3 37,8% tạo thành dd muối có nồng độ 41,72%. Khi làm lạnh dd này thu được 8,08 gam muối kết tinh. Lọc tách chất rắn, dd còn lại có nồng độ chất tan là 34,7%. Xác định công thức muối kết tinh.
3 Đốt cháy hoàn toàn 12 gam muối sunfua kim loại R (hoa trị II) thu được chất rắn A khí B hòa tan hết A bằng một lượng vừa đủ H2SO4 24,5% thu được dd muối có nồng độ 33,33%. Làm lạnh dd muối thì có 1 lượng tinh thể muối ngậm nước tách ra có khối lượng 15,625 gam. Phần dd bão hòa còn lại có nồng độ 22,54%. Xác định R và công thức tinh thể muối ngậm nước.