Hỗn hợp A gồm Al2O3 và Fe3O4. Hòa tan hoàn toàn 7,33 gam A cần 77,41 ml dung dịch HCl 12,9% (D = 1,06 g/ml).
1. Viết các PTHH xảy ra.
2. Xác định khối lượng và % khối lượng từng chất trong A.
3. Tính thể tích dung dịch KOH 4M đủ để phản ứng với Al2O3 có trong 3,665 gam A.


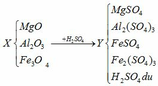
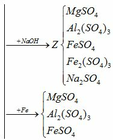
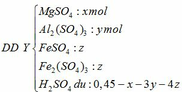
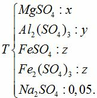
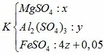

a, PT: \(Al_2O_3+6HCl\rightarrow2AlCl_3+3H_2O\)
\(Fe_3O_4+8HCl\rightarrow FeCl_2+2FeCl_3+4H_2O\)
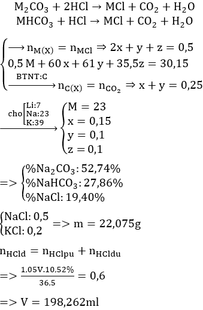
b, Gọi: \(\left\{{}\begin{matrix}n_{Al_2O_3}=x\left(mol\right)\\n_{Fe_3O_4}=y\left(mol\right)\end{matrix}\right.\) ⇒ 102x + 232y = 7,33 (1)
Ta có: \(m_{ddHCl}=77,41.1,06=82,0546\left(g\right)\Rightarrow m_{HCl}=82,0546.12,9\%=10,585\left(g\right)\)
\(\Rightarrow n_{HCl}=\dfrac{10,585}{36,5}=0,29\left(mol\right)\)
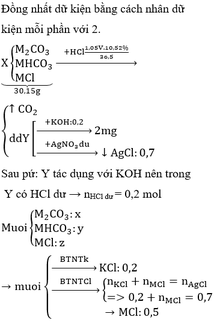
Theo PT: \(n_{HCl}=6n_{Al_2O_3}+8n_{Fe_3O_4}=6x+8y=0,29\left(2\right)\)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}x=0,015\left(mol\right)\\y=0,025\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}m_{Al_2O_3}=0,015.102=1,53\left(g\right)\\m_{Fe_3O_4}=0,025.232=5,8\left(g\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{Al_2O_3}=\dfrac{1,53}{7,33}.100\%\approx20,87\%\\\%m_{Fe_3O_4}\approx79,13\%\end{matrix}\right.\)
c, Ta có: \(n_{Al_2O_3}=0,015.\dfrac{3,665}{7,33}=0,0075\left(mol\right)\)
PT: \(Al_2O_3+2KOH\rightarrow2KAlO_2+H_2O\)
Theo PT: \(n_{KOH}=2n_{Al_2O_3}=0,015\left(mol\right)\)
\(\Rightarrow V_{ddKOH}=\dfrac{0,015}{4}=0,00375\left(l\right)=3,75\left(ml\right)\)