Dựa vào điều kiện phản ứng với hydrogen và giá trị năng lượng liên kết của phân tử H – X, giải thích khả năng phản ứng của các halogen với hydrogen.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


- Benzene phản ứng với Br2 trong điều kiện đun nóng và có xúc tác FeBr3.
- Phenol phản ứng với Br2 ngay điều kiện thường và không cần chất xúc tác.
=> Điều này đã chứng minh rằng ảnh hưởng của nhóm – OH, phản ứng thế nguyên tử hydrogen ở vòng benzene của phenol xảy ra dễ dàng hơn so với benzene.

1.
- Từ F2 đến I2, tính oxi hóa của các halogen giảm dần
=> Khả năng hoạt động của các đơn chất halogen giảm dần
=> Xu hướng phản ứng với hydrogen giảm dần
2.
- Dựa vào Bảng 12.2 ta nhận thấy: Từ F đến I, năng lượng liên kết của halogen với hydrogen giảm dần
=> Khả năng halogen liên kết với hydrogen giảm dần
=> Xu hướng phản ứng của các đơn chất halogen với hydrogen giảm dần từ F2 đến I2

- Giá trị năng lượng liên kết của:
+ F – F trong phân tử F2: 159 kJ mol-1
+ N = N trong phân tử N2: 418 kJ mol-1
⟹ Năng lượng liên kết của F – F < N = N.
⟹ Liên kết của N2 bền hơn F2.
- Vậy phản ứng giữa F2 với H2 thuận lợi hơn (dễ xảy ra hơn) so với phản ứng giữa N2 với H2.

- Tại nhiệt độ thường thì chlorine dễ phản ứng với hydrogen hơn.
- Vì liên kết ba giữa hai nguyên tử N trong phân tử nitrogen có năng lượng liên kết rất lớn (946 kJ mol-1) nên rất khó bị phá vỡ.

Tham khảo:
Khi tham gia phản ứng cộng hydrogen liên kết π trong phân tử alkene, alkyne bị phá vỡ. Do liên kết π kém bền nên dễ bị phá vỡ phi tham gia phản ứng cộng
Liên kết pi (trong các liên kết đôi, liên kết ba). Vì nó kém bền, dễ bị đứt gãy hơn.

- CT electron và CT Lewis của NH3:
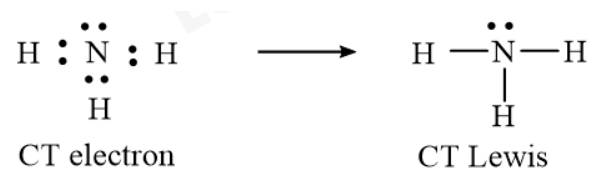
⟹ NH3 còn 1 cặp electron riêng của N.
- Vì N còn 1 của phân tử NH3 còn 1 cặp electron riêng và có độ âm điện lớn hơn nguyên tử H của phân tử H2O.
⟹ Một phân tử H2O có khả năng tạo thành liên kết hydrogen với một phân tử NH3, liên kết tạo bởi H và N.

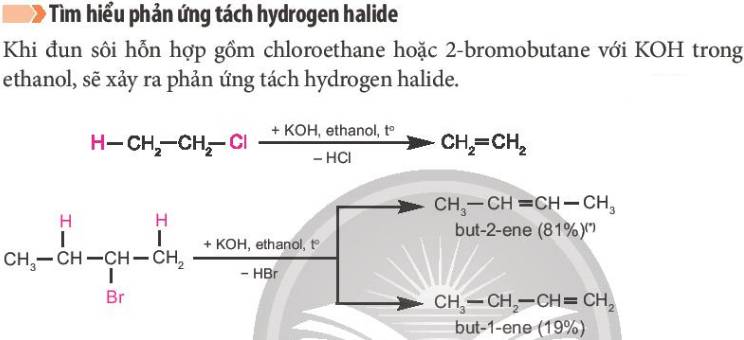
Trong phản ứng tách hydrogen halide, nguyên tử hydrogen ở nguyên tử carbon bên cạnh được tách cùng với nguyên tử halogen ra khỏi dẫn xuất.
Trong đó, nguyên tử halogen ưu tiên tách ra cùng với nguyên tử hydrogen ở nguyên tử carbon bên cạnh có bậc cao hơn, tạo ra sản phẩm chính.
(Nhìn sơ đồ trong hình là có thể thấy rõ, sp chính là sản phẩm có % tạo thành nhiều hơn so với sp phụ)
Trong phản ứng tách hydrogen halide, nguyên tử hydrogen ở nguyên tử carbon bên cạnh (carbon chứa halogen) được tách cùng với nguyên tử halogen ra khỏi dẫn xuất.
Nguyên tử halogen (X) ưu tiên tách ra cùng với nguyên tử hydrogen (H) ở nguyên tử carbon bên cạnh có bậc cao hơn, tạo ra sản phẩm chính (Quy tắc Zaitsev).

Khả năng phân cắt liên kết C−X của các dẫn xuất halogen: C-F < C-Cl < C-Br < C-I.

∆r\(H^o_{298}\) = EH-H + EF-F – 2.FH-F
∆r\(H^o_{298}\) = 436 + 159 – 2.565 = -535 kJ

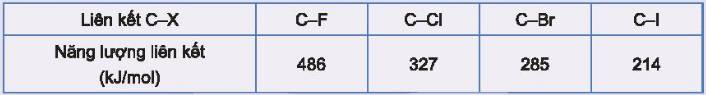
- Đi từ F đến I
+ Điều kiện phản ứng với hydrogen khó dần
+ Năng lượng liên kết H-X giảm dần => Độ bền H-X giảm dần
=> Khả năng phản ứng của các halogen với hydrogen giảm dần