Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

1.
- Từ F2 đến I2, tính oxi hóa của các halogen giảm dần
=> Khả năng hoạt động của các đơn chất halogen giảm dần
=> Xu hướng phản ứng với hydrogen giảm dần
2.
- Dựa vào Bảng 12.2 ta nhận thấy: Từ F đến I, năng lượng liên kết của halogen với hydrogen giảm dần
=> Khả năng halogen liên kết với hydrogen giảm dần
=> Xu hướng phản ứng của các đơn chất halogen với hydrogen giảm dần từ F2 đến I2

- Giá trị năng lượng liên kết của:
+ F – F trong phân tử F2: 159 kJ mol-1
+ N = N trong phân tử N2: 418 kJ mol-1
⟹ Năng lượng liên kết của F – F < N = N.
⟹ Liên kết của N2 bền hơn F2.
- Vậy phản ứng giữa F2 với H2 thuận lợi hơn (dễ xảy ra hơn) so với phản ứng giữa N2 với H2.

- CT electron và CT Lewis của NH3:
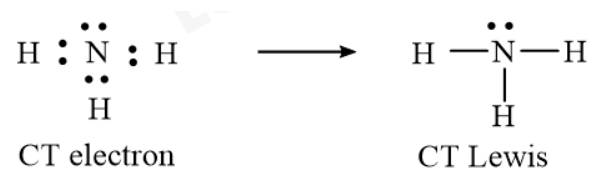
⟹ NH3 còn 1 cặp electron riêng của N.
- Vì N còn 1 của phân tử NH3 còn 1 cặp electron riêng và có độ âm điện lớn hơn nguyên tử H của phân tử H2O.
⟹ Một phân tử H2O có khả năng tạo thành liên kết hydrogen với một phân tử NH3, liên kết tạo bởi H và N.

∆r\(H^o_{298}\) = EH-H + EF-F – 2.FH-F
∆r\(H^o_{298}\) = 436 + 159 – 2.565 = -535 kJ



a)
- Xét phản ứng: F2(g) + H2(g) → 2HF (g)
+ Ta có: ∆rH0298 = Eb(F2) + Eb(H2) – 2xEb(HF) = 159 + 436 – 2x565 = -535 (kJ/mol)
- Xét phản ứng: O2(g) + 2H2(g) → 2H2O(g)
+ Ta có: ∆rH0298 = Eb(O2) + 2xEb(H2) – 2x2xEb(OH) = 142 + 2x436 – 2x2x464 = -842 (kJ/mol)
b)
Giá trị biến thiên enthalpy của phản ứng (2) âm hơn giá trị biến thiên enthalpy của phản ứng (1)
=> Phản ứng oxi hóa – khử (2) diễn ra thuận lợi hơn
a) Phương trình F2(g) + H2(g) → 2HF(g)
Δ𝑟𝐻0298 = -535 kJ
Phương trình: O2(g) + 2H2(g) → 2H2O (g)
Δ𝑟𝐻0298 = -842 kJ
b ) Phản ứng của oxygen thuận lợi hơn


- Đi từ F đến I
+ Điều kiện phản ứng với hydrogen khó dần
+ Năng lượng liên kết H-X giảm dần => Độ bền H-X giảm dần
=> Khả năng phản ứng của các halogen với hydrogen giảm dần