Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

- Đi từ F đến I
+ Điều kiện phản ứng với hydrogen khó dần
+ Năng lượng liên kết H-X giảm dần => Độ bền H-X giảm dần
=> Khả năng phản ứng của các halogen với hydrogen giảm dần

a)
- Xét phản ứng đốt cháy 1 mol C2H4
C2H4 (g) + 3O2 (g) → 2CO2 (g)+ 2H2O (g)
∆fH0298 = 1 x Eb (C2H4) + 3 x Eb (O2) - 2 x Eb (CO2) - 2 x Eb (H2O)
∆fH0298 = 1 x EC=C + 4 x EC-H + 3 x EO2 – 2 x 2EC=O – 2 x 2EO-H
∆fH0298 = 1x611 + 4x414 + 3x498 – 2x2x799 – 2x2x464 = -1291kJ
- Xét phản ứng đốt cháy 1 mol C2H6
C2H6 (g) + 7/2 O2 (g) → 2CO2 (g)+ 3H2O (g)
∆fH0298 = 1 x Eb (C2H6) + 7/2 x Eb (O2) - 2 x Eb (CO2) - 3 x Eb (H2O)
∆fH0298 = 1 x EC-C + 6 x EC-H + 7/2 x EO2 – 2 x 2EC=O – 3 x 2EO-H
∆fH0298 = 1x347 + 6x414 + 7/2 x498 – 2x2x799 – 3x2x464 = -1406kJ
- Xét phản ứng đốt cháy 1 mol CO
CO(g) + ½ O2 (g) → CO2(g)
∆fH0298 = 1 x Eb (CO) + 1/2 x Eb (O2) - 1 x Eb (CO2)
∆fH0298 = 1 x ECO + 1/2 x EO2 – 1 x 2EC=O
∆fH0298 = 1 x 1072 + 1/2 x 498– 1x2x799 = -277kJ
b)
F2(g) + H2O(g) → 2HF(g) + ½ O2 (g)
∆fH0298 = 1 x Eb (F2) + 1 x Eb (H2O) - 2 x Eb (HF) – 1/2 x Eb (O2)
∆fH0298 = 1 x EF-F + 1x2EO-H - 2 x EH-F - 1/2 x EO2
∆fH0298 = 1 x 159 + 2x464– 2x565 - 1/2 x 498= -292kJ
Các phản ứng trên đều có giá trị elthanpy âm => Các phản ứng trên đều thuận lợi

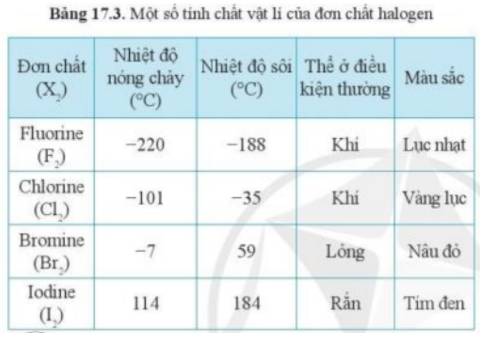
- Theo bảng 17.3, xu hướng biến đổi trạng thái của các halogen ở điều kiện thường từ: khí → lỏng → rắn
- Mà astatine đứng dưới cùng trong nhóm halogen
=> Astatine tồn tại ở thể rắn trong điều kiện thường
- Giải thích: Do sự tăng khối lượng phân tử và sự tăng tương tác van dể Waals

∆r\(H^o_{298}\) = EH-H + EF-F – 2.FH-F
∆r\(H^o_{298}\) = 436 + 159 – 2.565 = -535 kJ

Chọn đáp án A
(1) Trong nhóm halogen, tính phi kim và độ âm điện giảm dần từ flo đến iot.
Đúng.Theo SGK lớp 10.
(2) Các halogen đều có các trạng thái oxi hóa -1, 0, +1, +3,+5, +7.
Sai.Flo chỉ có -1 và 0
(3) Các halogen đều có tính oxi hóa mạnh, chúng phản ứng được với hầu hết kim loại, với hiđro và nhiều hợp chất.
Đúng.Theo SGK lớp 10
(4) Trong dãy axit không chứa oxi của halogen từ HF đến HI tính axit và tính khử tăng dần.
Sai.Tính khử và tính axit giảm dần
(5) Cho các dung dịch muối NaX (X là halogen) tác dụng với dung dịch AgNO3 đều thu được kết tủa AgX.
Sai.AgF là chất tan

a)
- Xét phản ứng: F2(g) + H2(g) → 2HF (g)
+ Ta có: ∆rH0298 = Eb(F2) + Eb(H2) – 2xEb(HF) = 159 + 436 – 2x565 = -535 (kJ/mol)
- Xét phản ứng: O2(g) + 2H2(g) → 2H2O(g)
+ Ta có: ∆rH0298 = Eb(O2) + 2xEb(H2) – 2x2xEb(OH) = 142 + 2x436 – 2x2x464 = -842 (kJ/mol)
b)
Giá trị biến thiên enthalpy của phản ứng (2) âm hơn giá trị biến thiên enthalpy của phản ứng (1)
=> Phản ứng oxi hóa – khử (2) diễn ra thuận lợi hơn
a) Phương trình F2(g) + H2(g) → 2HF(g)
Δ𝑟𝐻0298 = -535 kJ
Phương trình: O2(g) + 2H2(g) → 2H2O (g)
Δ𝑟𝐻0298 = -842 kJ
b ) Phản ứng của oxygen thuận lợi hơn

Nhiệt độ nóng chảy, nhiệt độ sôi tăng từ F2 đến I2 do:
- Tương tác van der Waals giữa các phân tử tăng.
- Khối lượng phân tử tăng.

- Giá trị năng lượng liên kết của:
+ F – F trong phân tử F2: 159 kJ mol-1
+ N = N trong phân tử N2: 418 kJ mol-1
⟹ Năng lượng liên kết của F – F < N = N.
⟹ Liên kết của N2 bền hơn F2.
- Vậy phản ứng giữa F2 với H2 thuận lợi hơn (dễ xảy ra hơn) so với phản ứng giữa N2 với H2.

1.
- Từ F2 đến I2, tính oxi hóa của các halogen giảm dần
=> Khả năng hoạt động của các đơn chất halogen giảm dần
=> Xu hướng phản ứng với hydrogen giảm dần
2.
- Dựa vào Bảng 12.2 ta nhận thấy: Từ F đến I, năng lượng liên kết của halogen với hydrogen giảm dần
=> Khả năng halogen liên kết với hydrogen giảm dần
=> Xu hướng phản ứng của các đơn chất halogen với hydrogen giảm dần từ F2 đến I2