4. Hoà tan hoàn toàn 2,86 gam Na2CO3.xH2O vào nước. Ta thu được 100ml dung dịch Na2CO3 0,1M. Xác định CTPT của muối ngậm nước trên.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

3.
- Ta có: m dd CaCl2 = 43,8 + 156,2 = 200 (g)
Mà: C%CaCl2 = 11,1%
\(\Rightarrow\dfrac{m_{CaCl_2}}{m_{ddCaCl_2}}=0,111\) \(\Rightarrow m_{CaCl_2}=22,2\left(g\right)\) \(\Rightarrow n_{CaCl_2}=\dfrac{22,2}{111}=0,2\left(mol\right)\)
Có: \(n_{CaCl_2}=n_{CaCl_2.xH_2O}=\dfrac{43,8}{111+18x}=0,2\left(mol\right)\)
⇒ x = 6
Vậy: CTPT cần tìm là CaCl2.6H2O
- Ta có: \(n_{Na_2CO_3.xH_2O}=n_{Na_2CO_3}=0,1.0,1=0,01\left(mol\right)\)
\(\Rightarrow\dfrac{2,86}{106+18x}=0,01\)
⇒ x = 10
Vậy: CTPT cần tìm là Na2CO3.10H2O.

Số mol kết tủa tạo thành:
n(BaSO4) = 0,699/233 = 0,003mol
Al2(SO4)3 + 3BaCl2 → 3BaSO4 + 2AlCl3
0,001 0,003
Số mol Al2(SO4)3 có trong dung dịch A:
n[Al2(SO4)3] = 0,001.10 = 0,01mol
Khối lượng mol phân tử của muối hidrat:
M[Al2(SO4)3.nH2O] = 342 + 18n = 6,66/0,01 = 666
→ n = (666-342)/18 = 18
Vậy công thức tinh thể muối nhôm sunfat là Al2(SO4)3.18H2O

\(S_{Na_2CO_3}=\dfrac{53}{250}.100=21,2\)
\(C\%=\dfrac{53}{250+53}.100\%=17,5\%\)

Bảo toàn khối lượng: mX + mNaOH = mmuoi + mH2O
=> mH2O = 15,2 + 40*0,3 - 23,6 = 3,6 => mol H2O = 0,2
mol Na2CO3 = 0,5mol NaOH = 0,15 => mNa2CO3 = 106*0,15 = 15,9 mol CO2 = 14,56/22,4 = 0,65 và mol H2O = 6,3/18 = 0,35
=> mO2 = 44*0,65 + 6,3 + 15,9 - 23,6 = 27,2 => mol O2 = 0,85
CxHyOz + NaOH ---> muối + H2O (1)
a-------------0,3------------------0,2
muối + O2 ----> CO2 + H2O + Na2CO3 (2)
--------0,85-----0,65----0,35-----0,15
Cộng (1), (2):
CxHyOz + NaOH + O2 ----> CO2 + H2O + Na2CO3
a-------------0,3----0,85------0,65---0,55-----0,15
Bảo toàn mol C = ax = 0,65+0,15 = 0,8
Bảo toàn mol H: = ay + 0,3 = 2*0,55 => ay = 0,8
Bảo toàn mol O: az + 0,3 + 2*0,85 = 2*0,65 + 0,55 + 3*0,15 => az = 0,3
ax : ay : az = 0,8 : 0,8 : 0,3 => x : y : z = 8 : 8 : 3 => C8H8O3
Từ đây ta tìm được 8 đồng phân thỏa mãn A
=> Đáp án D

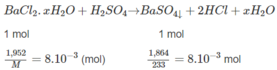
⇒ M = 244g/mol = M B a C l 2 . x H 2 O . Từ đó :
⇒ x = 2.
Đáp số : B a C l 2 . x H 2 O

Câu 2 :
Trích mẫu thử
Cho nước vào các mẫu thử
- mẫu thử nào không tan là BaSO4, CaCO3. Gọi là nhóm 1
- mẫu thử nào tan là Na2CO3,NaCl. Gọi là nhóm 2
Cho dung dịch HCl vào các mẫu thử nhóm 1 và 2
Trong nhóm 1 :
- mẫu thử nào tan, tạo khí là CaCO3
\(CaCO_3 + 2HCl \to CaCl_2 + CO_2 +H_2O\)
- mẫu thử không hiện tượng là BaSO4
Trong nhóm 2 :
- mẫu thử nào tạo khí là Na2CO3
\(Na_2CO_3 + 2HCl \to 2NaCl + CO_2 +H_2O\)
- mẫu thử không hiện tượng là NaCl
Câu 1 :
\(R + 2H_2O \to R(OH)_2 + H_2\\ n_R = n_{H_2} = \dfrac{2,24}{22,4} = 0,1(mol)\\ \Rightarrow R = \dfrac{13,7}{0,1} = 137(Bari)\\ m_{dd\ X} = 13,7 + 100 - 0,1.2 = 113,5(gam)\\ n_{Ba(OH)_2} = n_{H_2} = 0,1(mol)\\ \Rightarrow C\%_{Ba(OH)_2} = \dfrac{0,1.171}{113,5}.100\% = 15,07\% \)

Độ tan của muối Na 2 CO 3 ở 18 º C là: S = (53 x 100)/250 = 21,2 (gam).
`m_[H_2 O]=2,86-0,1.0,1.106=1,8(g)`
`=>n_[H_2 O]=[1,8]/18=0,1(mol)`
`=>x=[0,1]/[0,1.0,1]=10`
`=>CTPT` của muối ngậm nước là: `Na_2 CO_3 .10H_2 O`