Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

3.
- Ta có: m dd CaCl2 = 43,8 + 156,2 = 200 (g)
Mà: C%CaCl2 = 11,1%
\(\Rightarrow\dfrac{m_{CaCl_2}}{m_{ddCaCl_2}}=0,111\) \(\Rightarrow m_{CaCl_2}=22,2\left(g\right)\) \(\Rightarrow n_{CaCl_2}=\dfrac{22,2}{111}=0,2\left(mol\right)\)
Có: \(n_{CaCl_2}=n_{CaCl_2.xH_2O}=\dfrac{43,8}{111+18x}=0,2\left(mol\right)\)
⇒ x = 6
Vậy: CTPT cần tìm là CaCl2.6H2O
- Ta có: \(n_{Na_2CO_3.xH_2O}=n_{Na_2CO_3}=0,1.0,1=0,01\left(mol\right)\)
\(\Rightarrow\dfrac{2,86}{106+18x}=0,01\)
⇒ x = 10
Vậy: CTPT cần tìm là Na2CO3.10H2O.

Số mol kết tủa tạo thành:
n(BaSO4) = 0,699/233 = 0,003mol
Al2(SO4)3 + 3BaCl2 → 3BaSO4 + 2AlCl3
0,001 0,003
Số mol Al2(SO4)3 có trong dung dịch A:
n[Al2(SO4)3] = 0,001.10 = 0,01mol
Khối lượng mol phân tử của muối hidrat:
M[Al2(SO4)3.nH2O] = 342 + 18n = 6,66/0,01 = 666
→ n = (666-342)/18 = 18
Vậy công thức tinh thể muối nhôm sunfat là Al2(SO4)3.18H2O

\(S_{Na_2CO_3}=\dfrac{53}{250}.100=21,2\)
\(C\%=\dfrac{53}{250+53}.100\%=17,5\%\)

Độ tan của muối Na 2 CO 3 ở 18 º C là: S = (53 x 100)/250 = 21,2 (gam).

1ml dung dịch cho khối lượng 1,05 gam
200 ml dung dịch cho khối lượng m dd = 210 gam
Nồng độ phần trăm:
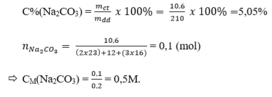

1ml dung dịch cho khối lượng 1,05 gam
200 ml dung dịch cho khối lượng mdd = 210 gam
Nồng độ phần trăm:
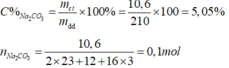
C M Na 2 CO 3 = 0 , 1 : 0 , 2 = 0 , 5 M .

\(n_{Na_2CO_3}=\dfrac{10,6}{106}=0,1\left(mol\right)\\ \rightarrow C_{M\left(Na_2CO_3\right)}=\dfrac{0,1}{0,2}=0,5M\)
Ta có: \(C\%=\dfrac{C_M.M}{10.D}\)
\(\rightarrow C\%=\dfrac{0,5.106}{10.1,05}=5,05\%\)
`m_[H_2 O]=2,86-0,1.0,1.106=1,8(g)`
`=>n_[H_2 O]=[1,8]/18=0,1(mol)`
`=>x=[0,1]/[0,1.0,1]=10`
`=>CTPT` của muối ngậm nước là: `Na_2 CO_3 .10H_2 O`