hòa tan hoàn toàn 4,6g kim loại Na vào nước. a) Viết phương trình hóa học xảy ra. b)tính thể tích khi thu được ở điều kiện tiêu chuẩn. c)Dẫn toàn bộ lượng khí thu được ở trên qua ống sứ đựng 16g CuO đun nóng. Sau khi phản ứng xảy ra hoàn toàn thu được m gam chất rắn. Tính m
giúp mình giải quyết nhanh vs ạ

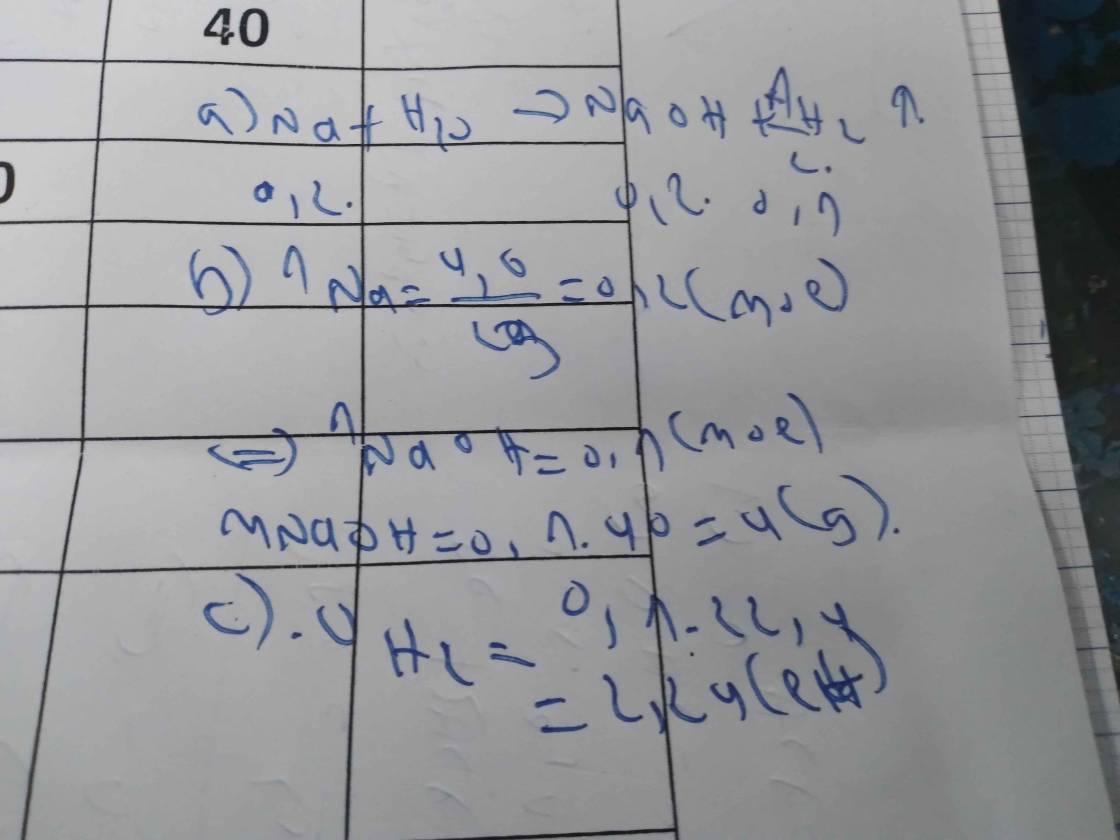
a) Pt: 2Na + 2H2O \(\rightarrow\) 2NaOH + H2
b) nNa = \(\dfrac{4,6}{23}=0,2mol\)
Theo pt: \(n_{H_2}=\dfrac{1}{2}n_{Na}=0,1mol\)
=> \(V_{H_2}=0,1.22,4=2,24l\)
c) Pt: \(CuO+H_2\xrightarrow[]{t^o}Cu+H_2O\)
nCuO = 16 : 80 = 0,2mol
Có nCuO : nH2 = \(\dfrac{0,2}{1}:\dfrac{0,1}{1}=2:1\)
=> CuO dư
Theo pt: nCu = nH2 = 0,1mol
=> mCu = 0,1.64 = 6,4g
a)
2Na + 2H2O ---> 2NaOH + H2.
b) Ta có:
nNa = 4,6/23 = 0,2 (mol)
Từ pt => nH2 = 0,2/2 = 0,1 (mol)
=> VH2 = 0,1.22,4 = 2,24 (lít)
c) CuO + H2 --to--> Cu + H2O
Ta có:
nCuO = 16/(64 + 16) = 0,2 (mol)
Lập tỉ lệ:
nCuO(tt)/nCuO(pt) = 0,2/1 = 0,2
nH2(tt)/nH2(pt) = 0,1/1 = 0,1
Vì 0,2 > 0,1 nên CuO dư
=> tính theo số mol của H2 => nCuO = 0,1 (mol)
Khối lượng chất rắn cần tìm là:
mCu = 0,1.64 = 6,4 (g)