cho 6,5 g kẽm phản ứng hoàn toàn với 200 ml dd axit sunfuric loãng sau phản ứng thu được ZnSO4 và hidro . a) viết phương trình phản ứng . b) tính V hidro .c) tính nồng độ mol của dd H2SO4 ở trên(nhờ các vị hảo hán giúp vs :))) )
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


a, \(Zn+H_2SO_4\rightarrow ZnSO_4+H_2\)
b, \(n_{Zn}=\dfrac{19,5}{65}=0,3\left(mol\right)\)
Theo PT: \(n_{H_2}=n_{Zn}=0,3\left(mol\right)\Rightarrow V_{H_2}=0,3.22,4=6,72\left(l\right)\)
c, \(n_{ZnSO_4}=n_{Zn}=0,3\left(mol\right)\Rightarrow m_{ZnSO_4}=0,3.161=48,3\left(g\right)\)
d, \(n_{Fe_2O_3}=\dfrac{64}{160}=0,4\left(mol\right)\)
PT: \(Fe_2O_3+3H_2\underrightarrow{t^o}2Fe+3H_2O\)
Xét tỉ lệ: \(\dfrac{0,4}{1}>\dfrac{0,3}{3}\), ta được Fe2O3 dư.
Mà: H% = 30% \(\Rightarrow n_{H_2\left(pư\right)}=0,3.30\%=0,09\left(mol\right)\)
Theo PT: \(\left\{{}\begin{matrix}n_{Fe}=\dfrac{2}{3}n_{H_2}=0,06\left(mol\right)\\n_{Fe_2O_3\left(pư\right)}=\dfrac{1}{3}n_{H_2}=0,03\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow n_{Fe_2O_3\left(dư\right)}=0,4-0,03=0,37\left(mol\right)\)
\(\Rightarrow a=m_{Fe}+m_{Fe_2O_3\left(dư\right)}=62,56\left(g\right)\)

a, \(Mg+2HCl\rightarrow MgCl_2+H_2\)
b, \(m_{Mg}=\dfrac{7,2}{24}=0,3\left(mol\right)\)
Theo PT: \(n_{MgCl_2}=n_{Mg}=0,3\left(mol\right)\Rightarrow m_{MgCl_2}=0,3.95=28,5\left(g\right)\)
c, \(n_{HCl}=2n_{Mg}=0,6\left(mol\right)\)
\(\Rightarrow C_{M_{HCl}}=\dfrac{0,6}{0,2}=3\left(M\right)\)

Gọi x, y lần lượt là sô mol của Fe và Mg
Ta có: \(n_{H_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
PTHH:
Fe + H2SO4 ---> FeSO4 + H2 (1)
Mg + H2SO4 ---> MgSO4 + H2 (2)
a. Theo PT(1): \(n_{H_2}=n_{Fe}=x\left(mol\right)\)
Theo PT(2): \(n_{H_2}=n_{Mg}=y\left(mol\right)\)
\(\Rightarrow x+y=0,3\) (*)
Theo đề, ta có: 56x + 24y = 10.4 (**)
Từ (*) và (**), ta có HPT:
\(\left\{{}\begin{matrix}x+y=0,3\\56x+24y=10,4\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}x=0,1\\y=0,2\end{matrix}\right.\)
\(\Rightarrow m_{Fe}=0,1.56=5,6\left(g\right);m_{Mg}=0,2.24=4,8\left(g\right)\)
b. Ta có: \(n_{hh}=0,1+0,2=0,3\left(mol\right)\)
Theo PT(1,2): \(n_{H_2SO_4}=n_{hh}=0,3\left(mol\right)\)
Đổi 200ml = 0,2 lít
\(\Rightarrow C_{M_{H_2SO_4}}=\dfrac{0,3}{0,2}=1,5M\)

\(n_{Zn}=\dfrac{13}{65}=0,2\left(mol\right)\)
PTHH: Zn + H2SO4 ---> ZnSO4 + H2
0,2--->0,2--------->0,2------>0,2
\(V_{H_2}=0,2.22,4=4,48\left(l\right)\\ m_{H_2SO_4}=\dfrac{0,2.98}{20\%}=98\left(g\right)\\ \rightarrow V_{ddH_2SO_4}=\dfrac{98}{1,14}=86\left(ml\right)=0,086\left(l\right)\\ \rightarrow C_{M\left(H_2SO_4\right)}=\dfrac{0,2}{0,086}=2,33M\)

a, \(Zn+2HCl\rightarrow ZnCl_2+H_2\)
\(n_{HCl}=0,15.4=0,6\left(mol\right)\)
Theo PT: \(n_{H_2}=\dfrac{1}{2}n_{HCl}=0,3\left(mol\right)\Rightarrow V_{H_2}=0,3.22,4=6,72\left(l\right)\)
b, \(n_{Zn}=\dfrac{1}{2}n_{HCl}=0,3\left(mol\right)\Rightarrow m_{Zn}=0,3.65=19,5\left(g\right)\)
c, \(n_{ZnCl_2}=\dfrac{1}{2}n_{HCl}=0,3\left(mol\right)\Rightarrow C_{M_{ZnCl_2}}=\dfrac{0,3}{0,15}=2\left(M\right)\)

a. \(n_{Zn}=\dfrac{6.5}{65}=0,1\left(mol\right)\)
PTHH : Zn + 2HCl -> ZnCl2 + H2
0,1 0,2 0,1
b. \(V_{H_2}=0,1.22,4=2,24\left(l\right)\)
c. \(m_{HCl}=0,2.36,5=7,3\left(g\right)\)
\(n_{Zn}=\dfrac{6,5}{65}=0,1mol\)
\(Zn+2HCl\rightarrow ZnCl_2+H_2\)
0,1 0,2 0,1
\(V_{H_2}=0,1\cdot22,4=2,24l\)
\(m_{HCl}=0,2\cdot36,5=7,3g\)

\(n_{Zn}=\dfrac{9,75}{65}=0,15\left(mol\right)\\ pthh:Zn+H_2SO_4\rightarrow ZnSO_4+H_2\)
0,15 0,15 0,15
\(V_{H_2}=0,15.22,4=3,36\left(l\right)\\
C_M=\dfrac{0,15}{0,1}=1,5M\)

a,\(n_{Zn}=\dfrac{6,5}{65}=0,1\left(mol\right)\)
PTHH: Zn + 2HCl ---> ZnCl2 + H2
0,1--------------->0,1------>0,1
b, => \(\left\{{}\begin{matrix}C_{M\left(ZnCl_2\right)}=\dfrac{0,1}{\dfrac{6}{1000}}=\dfrac{50}{3}M\\V_{H_2}=0,1.22,4=2,24\left(l\right)\end{matrix}\right.\)
c, \(n_{O_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
PTHH: 2H2 + O2 --to--> 2H2O
LTL: \(\dfrac{0,1}{2}< 0,1\)=> O2 dư
Theo pt: \(n_{O_2}=\dfrac{1}{2}n_{H_2}=\dfrac{1}{2}.0,1=0,05\left(mol\right)\)
\(\Rightarrow\left\{{}\begin{matrix}m_{O_2\left(dư\right)}=\left(0,1-0,05\right).32=1,6\left(g\right)\\V_{O_2\left(dư\right)}=\left(0,1-0,05\right).22,4=1,12\left(l\right)\end{matrix}\right.\)
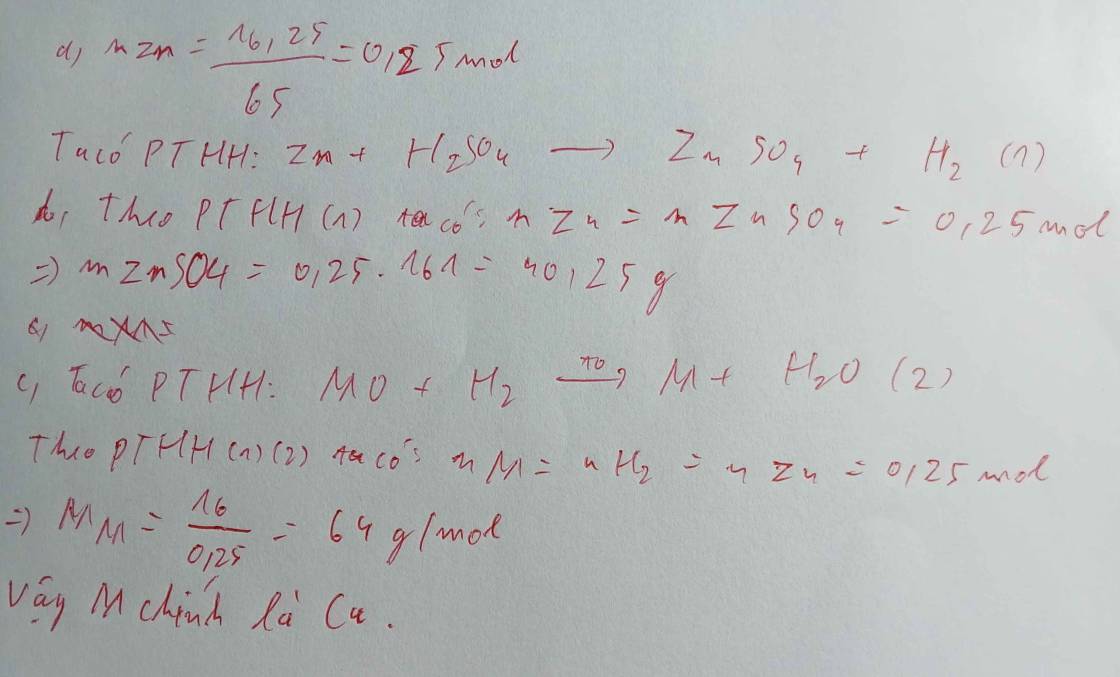
\(n_{Zn}=\dfrac{6,5}{65}=0,1mol\)
a)\(Zn+2HCl\rightarrow ZnCl_2+H_2\)
0,1 0,2 0,1 0,1
b)\(V_{H_2}=0,1\cdot22,4=2,24l\)
c)\(C_{M_{H_2SO_4}}=\dfrac{0,2}{0,2}=1M\)
nhầm r bn ơi zn tác dụng vs H2SO4 mà bn