Khi đun nóng hỗn hợp bột gồm 9.6 gam s và 22.4 gam sắt trong ông nghiệm kín không có không khí. Sau pứ hoàn toàn thu được răn y . Thành phần của rắn y là
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Đáp án B
Do P2 tác dụng với NaOH sinh ra H2 => Al dư sau phản ứng nhiệt nhôm => Y gồm Al dư, Fe, Al2O3
+P2: nAl dư=nH2/1,5=0,075 mol;
Chất rắn là Fe: nFe=8,4/56=0,15 mol
=>nAl/nFe=1/2
+ P1: Giả sử số mol
Al dư: x
Fe: 2x
BT e: 3nAl+3nFe=3nNO=>3x+3.2x=3.0,075=>x=0,025 mol
=>mAl2O3=6,025-0,025.27-0,05.56=2,55 g=>nAl2O3=0,025 mol
=>nO=3nAl2O3=0,075 mol
=>nFe/nO=0,05/0,075=2/3 (Fe2O3)
m=4mP1=6,025.4=24,1 gam

\(n_{Al}=\dfrac{8,1}{27}=0,3\left(mol\right)\)
\(n_S=\dfrac{9,6}{32}=0,3\left(mol\right)\)
Do khi hòa tan A vào HCl thu được hỗn hợp khí
=> Trong A chứa H2, H2S
=> Al dư, S hết
PTHH: 2Al + 3S --to--> Al2S3
0,2<--0,3------>0,1
2Al + 6HCl --> 2AlCl3 + 3H2
0,1----------------------->0,15
Al2S3 + 6HCl --> 2AlCl3 + 3H2S
0,1------------------------>0,3
=> \(\overline{M}_X=\dfrac{0,15.2+0,3.34}{0,15+0,3}=\dfrac{70}{3}\left(g/mol\right)\)
=> \(d_{X/H_2}=\dfrac{\dfrac{70}{3}}{2}=\dfrac{35}{3}\)

Đáp án B
Nhiệt phân hoàn toàn X ⇒ Y gồm Fe, Al2O3 và Al dư.
Xét phần 2: nAl = nH2 ÷ 1,5 = 0,01 mol; nFe = 0,045 mol
⇒ ne cho TỐI ĐA = 0,01 × 3 + 0,045 × 3 = 0,165 mol.
⇒ phần 1 gấp 0,165 × 3 ÷ 0,165 = 3 lần phần 2.
Xét phần 1: chứa 0,03 mol Al; 0,135 mol Fe.
⇒ nAl2O3 = (14,49 – 0,03 × 27 – 0,135 × 56) ÷ 102 = 0,06 mol.
⇒ nO = 0,18 mol ⇒ x : y = 0,135 ÷ 0,18 = 3 : 4 ⇒ Fe3O4.
m = 4/3 × 14,49 = 19,32(g)

Nhiệt phân hoàn toàn X
⇒ Y gồm Fe, Al2O3 và Al dư.
► Xét phần 2: nAl = nH2 ÷ 1,5 = 0,01 mol;
nFe = 0,045 mol
⇒ ne cho TỐI ĐA = 0,01 × 3 + 0,045 × 3 = 0,165 mol.
⇒ phần 1 gấp 0,165 × 3 ÷ 0,165 = 3 lần phần 2.
► Xét phần 1: chứa 0,03 mol Al; 0,135 mol Fe.
⇒ nAl2O3 = (14,49 – 0,03 × 27 – 0,135 × 56) ÷ 102 = 0,06 mol.
⇒ nO = 0,18 mol ⇒ x : y = 0,135 ÷ 0,18 = 3 : 4 ⇒ Fe3O4.
● m = × 14,49 = 19,32(g)
Đáp án B

Đáp án C
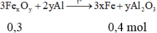
· Phần 2: + NaOH ® 0,015 mol H2
Þ Chứng tỏ phản ứng dư Al, oxit sắt phản ứng hết.
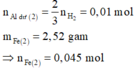
· Phần 1: 14,49 gam Y + HNO3 loãng, dư ® 0,165 mol NO.
Áp dụng bảo toàn electron có:

![]()
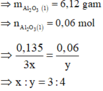
Þ Công thức oxit sắt là Fe3O4.
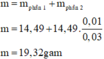

Phần 2 => mol Al = 0,01 ; mol Fe = 0,045 => ti lệ Al : Fe = 2/9
Đặt a, b, c là mol Al2O3 ; Al ; Fe
102a + 27b + 56c = 14,49
3b + 3c = 0,165*3
9b - 2c = 0
=> a = 0,06 ; b = 0,03 ; c = 0,135 => CT oxit sắt: Fe3O4
và phần 1 = 3*phần 2 => mol Al = 0,01 ; mol Fe = 0,045
=> ti lệ Al : Fe = 2/9 Đặt a, b, c là mol Al2O3 ; Al ; Fe
102a + 27b + 56c = 14,49 3b + 3c = 0,165*3
9b - 2c = 0
=> a = 0,06 ; b = 0,03 ; c = 0,135 => CT oxit sắt: Fe3O4
và phần 1 = 3*phần 2 => m = 19,32 2 => m = 19,32
=> Đap an B
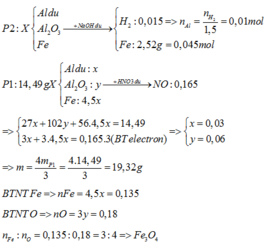
PTHH: \(Fe+S\underrightarrow{t^o}FeS\)
Ta có: \(\left\{{}\begin{matrix}n_S=\dfrac{9,6}{32}=0,3\left(mol\right)\\n_{Fe}=\dfrac{22,4}{56}=0,4\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\) Sắt còn dư, Lưu huỳnh p/ứ hết
\(\Rightarrow\) Chất rắn Y gồm FeS và Sắt dư