khử 9,6 gam đồng (ll) oxit bằng khí hiđro. hãy:
a)tính số gam đồng kim loại thu được;
b)tính thể tích khí hiđro (đktc)cần dùng.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

nCuO = 48 : 80 = 0,6 (Mol)
pthh : CuO + H2 -t--> Cu + H2O
0,6---->06------>0,6
=> mCu= 0,6 . 64 = 38,4 (G)
=> VH2 = 0,6 .22,4 = 13,44 (L)
a, \(n_{CuO}=\dfrac{48}{80}=0,6\left(mol\right)\)
PTHH: CuO + H2 --to--> Cu + H2O
0,6 0,6 0,6
\(\rightarrow\left\{{}\begin{matrix}m_{Cu}=0,6.64=38,4\left(g\right)\\V_{H_2}=0,6.22,4=13,44\left(l\right)\end{matrix}\right.\)

nCuO = 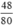 = 0,6 mol.
= 0,6 mol.
Phương trình hóa học của phản ứng khử CuO:
CuO + H2 → Cu + H2O.
nCu = 0,6mol.
mCu = 0,6 .64 = 38,4g.
Theo phương trình phản ứng trên:
nH2 = 0,6 mol
VH2 = 0,6 .22,4 = 13,44 lít.

3.
nHgO = 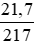
Phương trình hóa học của phản ứng khử HgO:
HgO + H2 → Hg + H2O
nHg = 0,1 mol.
mHg = 0,1 .201 = 20,1g.
nH2 = 0,1 mol.
VH2 = 0,1 .22,4 =2,24l.
1.
Phương trình phản ứng:
Fe3O4 + 4H2 → 4H2O + 3Fe
HgO + H2 → H2O + Hg
PbO + H2 → H2O + Pb

\(n_{CuO}=\dfrac{48}{80}=0,6\left(mol\right)\\
pthh:CuO+H_2\underrightarrow{t^o}Cu+H_2O\)
0,6 0,6 0,6 0,6
\(m_{Cu}=0,6.64=38,4g\\
V_{H_2}=0,6.22,4=13,44L\)

1/ \(CuO+H_2-^{t^o}\rightarrow Cu+H_2O\)
\(n_{Cu}=n_{CuO}=\dfrac{48}{80}=0,6\left(mol\right)\)
=> \(m_{Cu}=0,6.64=38,4\left(g\right)\)
\(n_{H_2}=n_{CuO}=0,6\left(mol\right)\)
=> \(V_{H_2}=0,6.22,4=13,44\left(l\right)\)
2. \(2H_2+O_2-^{t^o}\rightarrow2H_2O\)
\(n_{H_2}=0,375;n_{O_2}=0,125\)
Lập tỉ lệ \(\dfrac{0,375}{2}>\dfrac{0,125}{1}\)
=> Sau phản ứng H2 dư, tính theo số mol O2
\(n_{H_2O}=2n_{O_2}=0,25\left(mol\right)\)
=> \(m_{H_2O}=0,25.18=4,5\left(g\right)\)

nCuO = 16 : 80 = 0,2 (MOL)
pthh : CuO + H2 -t--> H2O + Cu
0,2---> 0,2---------------> 0,2 (mol)
=> mCu = 0,2 . 64 = 12,8 (g)
=> VH2 = 0,2. 22,4 = 4,48 ( l)
bai 5
Axit : HCl : Axit Clohidric
Oxit Axit : SO2 : luu huynh dioxt
Oxit bazo : Na2O : natri oxit
Muoi : Ca(HCO3)2 : canxi bisulfit
KCl : Kali Clorua
bazo : NaOH : Natri hidroxit

a, nCuO = 9,6/80 = 0,12 (mol)
PTHH: CuO + H2 -> (t°) Cu + H2O
Mol: 0,12 ---> 0,12 ---> 0,12
mCu = 0,12 . 64 = 7,68 (g)
b, VH2 = 0,12 . 22,4 = 2,688 (l)

`n_[CuO]=[0,8]/80=0,01(mol)`
`H_2 + CuO` $\xrightarrow{t^o}$ `Cu + H_2 O`
`0,01` `0,01` `0,01` `(mol)`
`a)m_[Cu]=0,01.64=0,64(g)`
`b)V_[H_2]=0,01.22,4=0,224(l)`
`c)`
`Fe + 2HCl -> FeCl_2 + H_2`
`0,01` `0,02` `0,01` `(mol)`
`@m_[Fe]=0,01.56=0,56(g)`
`@m_[dd HCl]=[0,02.36,5]/20 . 100=3,65(g)`
\(n_{CuO}=\dfrac{9,6}{80}=0,12mol\)
\(CuO+H_2\rightarrow Cu+H_2O\)
0,12 0,12 0,12
a)\(m_{Cu}=0,12\cdot64=7,68g\)
b)\(V=0,12\cdot22,4=2,688l\)
em còn hai bài nữa ạ