ngâm 10 gam hợp kim vào dung dịch HCl dư, khi phản ứng kết thúc thu được 6,72 lít khí hidro (đktc). Phần trăm khối lượng của Cu trong 10 gam hợp kim trên là
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Chọn đáp án B
Ta có n Z n = 0 , 05 ⇒ m Z n = 0 , 05 x 65 = 3 , 25 gam
⇒ m Cu = 10 - m Zn = 10 - 3 , 25 = 6 , 75 gam
⇒ % m C u / h h = 67 , 5 %
⇒ Chọn B

Đáp án B
Ta có nZn = 0,05 ⇒ mZn = 0,05×65 = 3,25 gam
⇒mCu = 10 – mZn = 10 – 3,25 = 6,75 gam
⇒ %mCu/hh = 67,5%

Đáp án B
Ta có nZn = 0,05 ⇒ mZn = 0,05×65 = 3,25 gam
⇒mCu = 10 – mZn = 10 – 3,25 = 6,75 gam
⇒ %mCu/hh = 67,5%

\(n_{H_2}=\dfrac{3.36}{22.4}=0.15\left(mol\right)\)
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
\(0.1..................................0.15\)
\(m_{Al}=0.1\cdot27=2.7\left(g\right)\)
\(m_{Cu}=10-2.7=7.3\left(g\right)\)
\(\%m_{Al}=\dfrac{2.7}{10}\cdot100\%=27\%\)
\(\%m_{Cu}=73\%\)

PTHH: \(Zn+2HCl\rightarrow ZnCl_2+H_2\uparrow\)
Ta có: \(n_{H_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
\(\Rightarrow\left\{{}\begin{matrix}n_{Zn}=0,3\left(mol\right)=n_{ZnCl_2}\\n_{HCl}=0,6\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}\%m_{Zn}=\dfrac{0.3\cdot65}{35,5}\cdot100\%\approx54,93\%\\\%m_{Cu}=45,07\%\\C\%_{HCl}=\dfrac{0,6\cdot36,5}{500}\cdot100\%=4,38\%\\m_{ZnCl_2}=0,3\cdot136=40,8\left(g\right)\end{matrix}\right.\)
Mặt khác: \(\left\{{}\begin{matrix}m_{Cu}=35,5-0,3\cdot65=16\left(g\right)\\m_{H_2}=0,3\cdot2=0,6\left(g\right)\end{matrix}\right.\)
\(\Rightarrow m_{dd}=m_{KL}+m_{ddHCl}-m_{Cu}-m_{H_2}=518,9\left(g\right)\)
\(\Rightarrow C\%_{ZnCl_2}=\dfrac{40,8}{518,9}\cdot100\%\approx7,86\%\)

PTHH: 2Al + 6HCl → 2AlCl3 + 3H2 ↑
Mg + 2HCl → MgCl2 + H2 ↑
Cu + HCl → Không phản ứng
%Cu trong hỗn hợp kim loại là: (2,5:12,7).100% = 19,7%
Khối lượng hỗn hợp Al và Mg là: 12,7 - 2,5 = 10,2 gam
Gọi số mol của Al là 2a , số mol của Mg là b
Số mol của H2 là: 11,2 : 22,4 = 0,5 mol
Ta có hệ pt:
=> a = 0,1 mol ; b = 0,2 mol
Khối lượng Al là: 27 . 2a = 27 . 2 . 0,1 = 5,4 gam
% Al trong hỗn hợp KL là: (5,4:12,7).100% = 42,52%
%Mg trong hỗn hợp là: 100% - 42,52% - 19,7% = 37,78%

Cu không tác dụng với axit HCl , do đó chất không tan là Cu và m Cu = 2,5 (gam).
Khối lượng Al và Mg bằng : 12,7 - 2,5 = 10,2 (gam)
Phương trình hoá học của phản ứng :
2Al + 6HCl → 2 AlCl 3 + 3 H 2
Mg + 2HCl → MgCl 2 + H 2
Theo phương trình hoá học trên và dữ kiện đề bài cho, ta có :
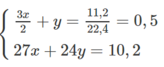
Giải ra, ta có : x = y = 0,2 mol
m Al = 0,2 x 27 = 5,4g
m Mg = 0,2 x 24 = 4,8g
% m Al = 5,4/12,7 .100% = 42,52%
% m Mg = 4,8/12,7 .100% = 37,8%
% m Cu = 100% - 42,52% - 37,8% = 19,68%
khi phản ứng kết thúc thu được 1,12 lít khí hidro.