Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Gọi số mol Zn, AL là a, b (mol)
=> 65a + 27b = 3,79 (1)
\(n_{H_2}=\dfrac{1,792}{22,4}=0,08\left(mol\right)\)
PTHH: Zn + H2SO4 --> ZnSO4 + H2
a---->a------------------->a
2Al + 3H2SO4 --> Al2(SO4)3 + 3H2
b---->1,5b-------------------->1,5b
=> a + 1,5b = 0,08 (2)
(1)(2) => a = 0,05; b = 0,02
=> \(\left\{{}\begin{matrix}\%m_{Zn}=\dfrac{0,05.65}{3,79}.100\%=85,752\%\\\%m_{Al}=\dfrac{0,02.27}{3,79}.100\%=14,248\%\end{matrix}\right.\)
\(n_{H_2SO_4}=a+1,5b=0,08\left(mol\right)\)
=> \(m_{H_2SO_4}=0,08.98=7,84\left(g\right)\)
Zn + H2SO4 -> ZnSO4 + H2
a -> a
2Al + 3H2SO4 -> Al2(SO4)3 + 3H2
b -> 1.5b
HPT: 65a+27b=3.79
a + 1.5b = 1.792/22.4= 0.08
Giải HPT ta được a=0.05 b=0.02
mZn = 0.05*65=3.25 (g)
mAl= 0.02*27=0.54 (g)

Đáp án B
Phương trình phản ứng:
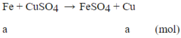
m tăng = (64-56).a = 1 ⇒a=0,125 mol
nFe = 0,125 ⇒nCu = (15-56.0,125)/64 = 0,125 mol
Thành phần phần trăm theo khối lượng:
⇒ % mCu = 53,33

Đáp án C
Ta có: n C u ( N O 3 ) 2 = 0 , 2 m o l , n A g N O 3 = 0 , 1 m o l
Ta có: 0,2.64 + 0,1.108 = 23,6 < 24,16 chứng tỏ Cu(NO3)2 và AgNO3 hết, còn kim loại dư.
Dung dịch Y tác dụng với HCl dư thu được 0,01 mol NO chứng tỏ Y chứa 0,03 mol Fe(NO3)2.
Bảo toàn điện tích:
![]()
Mặt khác do Y chứa Fe(NO3)2 nên kim loại chỉ có Fe dư và khối lượng Fe dư là 0,56 gam.
→ m X = 0,56 + 0,03.56 + 0,22.24 = 7,52 => %Fe = 29,97%

Đáp án B:
Đặt a, b, c lần lượt là số mol của Au, Ag và Cu
=> mx = 197a + 108b + 64c = 47,8 (1)
Bảo toàn electron ta có: 3nAu +nAg +2nCu = 3nNO
=>3a+b+2c = 0,72(2)
mAgCl =143,5b = 8,6l(3)


\(n_{SO2}=\dfrac{8,4}{22,4}=0,375\left(mol\right)\)
Pt : \(Cu+2H_2SO_{4đặc}\underrightarrow{t^o}CuSO_4+SO_2+2H_2O|\)
1 2 1 1 2
a 0,15 1a
\(2Fe+6H_2SO_{4đặc}\underrightarrow{t^o}Fe_2\left(SO_4\right)_3+3SO_2+6H_2O|\)
2 6 1 3 6
b 0,075 1,5b
a) Gọi a là số mol của Cu
b là số mol của Fe
\(m_{Cu}+m_{Fe}=18\left(g\right)\)
⇒ \(n_{Cu}.M_{Cu}+n_{Fe}.M_{Fe}=18g\)
⇒ 64a + 56b = 18g (1)
Theo phương trình : 1a + 1,5b = 0,375(2)
Từ(1),(2), ta có hệ phương trình :
64a + 56b = 18g
1a + 1,5b = 0,375
⇒ \(\left\{{}\begin{matrix}a=0,15\\b=0,15\end{matrix}\right.\)
\(m_{Cu}=0,15.64=9,6\left(g\right)\)
\(m_{Fe}=0,15.56=8,4\left(g\right)\)
b) 0/0Cu = \(\dfrac{9,.6.100}{18}=53,33\)0/0
0/0Fe = \(\dfrac{8,4.100}{18}=46,67\)0/0
c) Có : \(n_{Cu}=0,15\left(mol\right)\Rightarrow n_{CuSO4}=0,15\left(mol\right)\)
\(n_{Fe}=0,15\left(mol\right)\Rightarrow n_{Fe2\left(SO4\right)3}=0,075\left(mol\right)\)
\(m_{CuSO4}=0,15.160=24\left(g\right)\)
\(m_{Fe2\left(SO4\right)3}=0,075.400=30\left(g\right)\)
Chúc bạn học tốt

n Al = a(mol) ; n Fe = b(mol)
=> 27a + 56b = 20,65(1)
2Al + 3H2SO4 → Al2(SO4)3 + 3H2
a...........1,5a............0,5a............1.5a..(mol)
Fe + H2SO4 → FeSO4 + H2
b...........b..............b............b......(mol)
=> n H2 = 1,5a + b = 0,725(2)
Từ 1,2 suy ra a = 0,35 ; b = 0,2
Suy ra :
%m Al = 0,35.27/20,65 .100% = 45,76%
%m Fe = 100% -45,76% = 54,24%
m H2SO4 = (1,5a + b).98 = 71,05 gam
m muối = m kim loại + m H2SO4 -m H2 = 20,65 + 71,05 -0,725.2 = 90,25 gam
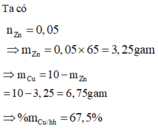
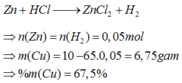
Đáp án B
Ta có nZn = 0,05 ⇒ mZn = 0,05×65 = 3,25 gam
⇒mCu = 10 – mZn = 10 – 3,25 = 6,75 gam
⇒ %mCu/hh = 67,5%