Cho 8,96 lít (đktc) hỗn hợp khí gồm N2 và H2 có tỉ lệ thể tích 1:3.Đun nóng hỗn hợp trên với xúc tác thích hợp tạo ra NH3.Sau khi dừng phản ứng thu được &,84 lít hỗn hợp khí (đktc).Tính hiệu suất của phản ứng.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Có: \(\left\{{}\begin{matrix}n_{N_2}+n_{H_2}=\dfrac{11,2}{22,4}=0,5\\\dfrac{n_{N_2}}{n_{H_2}}=\dfrac{1}{4}\end{matrix}\right.\)
=> nN2 = 0,1 (mol); nH2 = 0,4 (mol)
PTHH: \(N_2+3H_2\underrightarrow{t^o,p,xt}2NH_3\)
Xét tỉ lệ: \(\dfrac{0,1}{1}< \dfrac{0,4}{3}\) => N2 hết, H2 dư
PTHH: \(N_2+3H_2\underrightarrow{t^o,p,xt}2NH_3\)
______0,1---------------->0,2
=> VNH3 = 0,2.22,4 = 4,48 (l)

N2 + 3H2 \(\overset{t^o,p,xt}{⇌}\) 2NH3.
Cứ 1 lít N2 tác dụng với 3 lít H2 tạo ra 2 lít NH3. Vậy a lít N2 tác dụng với 3a lít H2 tạo ra 2a lít NH3, thu được (5-a)+(5-3a)+2a=7 (lít), suy ra a=1,5 (lít).
Thể tích mỗi khí trong hỗn hợp X gồm khí N2 (5-1,5=3,5 (lít)), khí H2 (5-3.1,5=0,5 (lít)) và khí NH3 (2.1,5=3 (lít)).
Hiệu suất phản ứng là H=(5-0,5)/5.100%=90% (hiệu suất tính theo H2 do H2 thiếu).

Gọi hh khí ban đầu là X và hh khí sản phẩm là Y.
\(d_{\dfrac{X}{H_2}}=3,6\rightarrow M_X=3,6.2=7,2\left(\dfrac{g}{mol}\right)\)
Ta có:
\(\dfrac{n_{N_2}}{n_{H_2}}=\dfrac{7,2-2}{28-7,2}=\dfrac{5,2}{20,8}=\dfrac{1}{4}\) ( quy tắc đường chéo )
Gọi x là số mol N2 tham gia phản ứng.
PTHH:
\(N_2+3H_2\xrightarrow[Fe]{t^o}2NH_3\)
Trc p/ư: 1 4
p/ư: x 3x 2x (mol)
sau p/ư: 1-x 4-3x 2x
\(\rightarrow n_Y=1-x+4-3x+2x=5-2x\left(mol\right)\)
\(d_{\dfrac{Y}{H_2}}=4,5\rightarrow M_Y=4,5.2=9\left(\dfrac{g}{mol}\right)\)
BTKL: mX = mY
\(m_Y=1.28+4.2=36\left(g\right)\)
\(\rightarrow\dfrac{36}{9}=5-2x\)
\(\rightarrow x=0,5\)
Giả sử phản ứng xảy ra hoàn toàn:
\(\dfrac{1}{1}< \dfrac{4}{3}\) --> N2 hết, H2 dư.
Trước:
\(\%V_{N_2}=\dfrac{1.22,4}{5.22,4}.100\%=20\%\)
\(\%V_{H_2}=100\%-20\%=80\%\)
Sau:
\(\%V_{NH_3}=\dfrac{1.22,4}{4.22,4}.100\%=25\%\)
\(\%V_{N_2}=\dfrac{\left(1-0,5\right).22,4}{4.22,4}.100\%=12,5\left(\%\right)\)
\(\%V_{H_2}=\dfrac{\left(4-1,5\right).22,4}{4.22,4}.100\%=62,5\%\)

a) \(N_2+3H_2-^{t^o}\rightarrow2NH_3\)
3..........8
Lập tỉ lệ \(\dfrac{3}{1}>\dfrac{8}{3}\) => Tính theo số mol H2
\(n_{H_2\left(pứ\right)}=8.60\%=4,8\left(mol\right)\)
=> \(n_{NH_3}=\dfrac{4,8.2}{3}=3,2\left(mol\right)\)
=> \(V_{NH_3}=3,2.22,4=71,68\left(l\right)\)
b) Hỗn hợp A gồm N2 dư, H2 dư, NH3
\(n_{N_2\left(dư\right)}=3-\dfrac{4,8}{3}=1,4\left(mol\right)\)
\(n_{H_2\left(dư\right)}=8-4,8=3,2\left(mol\right)\)
\(M_A=\dfrac{3,2.2+1,4.28+3,2.17}{3,2+1,4+3,2}=12,82\)
=>dA/H2 \(=\dfrac{12,82}{2}=6,41\)


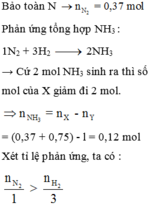

\(N_2+3H_2\leftrightarrow2NH_3\)
ban đầu: 1 mol 3 mol
phản ứng: a → 3a → 2a
dư: 1 – a 3 – 3a 2a
=> n hỗn hợp sau phản ứng = 1–a+3–3a+2a = 4 – 2a
n hỗn hợp trước phản ứng = 1 + 3 = 4 mol
Bảo toàn khối lượng:
m trước = m sau => Mt.n t = Ms.ns
\(\Rightarrow\dfrac{M_t}{M_s}=\dfrac{n_s}{n_t}\Rightarrow\dfrac{4-2a}{4}=0,6\\ \Rightarrow a=0,8\\ \Rightarrow H=\dfrac{0,8}{1}\cdot100\%=80\%\)