Cho sơ đồ phản ứng sau: K + H2O --> KOH + H2
Khối lượng kali cần dùng để điều chế được 2,24 lít H2 (đktc) là (Cho K=39)
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(n_{O_2\left(dktc\right)}=\dfrac{V}{22,4}=\dfrac{11,2}{22,4}=0,5\left(mol\right)\\ PTHH:2KClO_3-^{t^o}>2KCl+3O_2\)
tỉ lệ 2 : 2 : 3
n(mol) `1/3`<------------`1/3`<-----`0,5`
\(m_{KClO_3}=n\cdot M=\dfrac{1}{3}\cdot\left(39+35,5+16\cdot3\right)\approx40,83\left(g\right)\)

a) \(2KNO_3\underrightarrow{t^o}2KNO_2+O_2\)
Phản ứng phân hủy
b) \(n_{O_2}=\dfrac{1,68}{22,4}=0,075\left(mol\right)\)
PTHH: 2KNO3 --to--> 2KNO2 + O2
0,15<--------------------0,075
=> \(m_{KNO_3\left(PTHH\right)}=0,15.101=15,15\left(g\right)\)
=> mKNO3 (thực tế) = \(\dfrac{15,15.100}{85}=17,824\left(g\right)\)
c) \(n_{KNO_3\left(pư\right)}=\dfrac{10,1.80\%}{101}=0,08\left(mol\right)\)
=> nO2 = 0,04 (mol)
=> VO2 = 0,04.22,4 = 0,896(l)

\(n_K=\dfrac{3,9}{39}=0,1mol\)
\(2K+2H_2O\rightarrow2KOH+H_2\)
0,1 0,1 0,05 ( mol )
\(m_{KOH}=0,1.56=5,6g\)
\(V_{H_2}=0,05.22,4=1,12l\)

a, \(2K+2H_2O\rightarrow2KOH+H_2\)
b, \(n_K=\dfrac{3,9}{39}=0,1\left(mol\right)\)
Theo PT: \(n_{KOH}=n_K=0,1\left(mol\right)\Rightarrow m_{KOH}=0,1.56=5,6\left(g\right)\)
\(n_K=\dfrac{m}{M}=\dfrac{3,9}{39}=0,1\left(mol\right)\\ PTHH:2K+2H_2O->2KOH+H_2\)
tỉ lệ 2 : 2 : 2 ; 1
n(mol) 0,1---.0,1------>0,1------>0,05
\(m_{KOH}=n\cdot M=0,1\cdot\left(39+16+1\right)=5,6\left(g\right)\)

2KClO3-to\xt->2KCl+3O2
0,1------------------0,1
n KClO3=\(\dfrac{12,25}{122,5}\)=0,1 mol
=>m KCl=0,1.74,5=7,45g
H=\(\dfrac{6,8}{7,45}.100\)=91,275%
b)
2KClO3-to\xt->2KCl+3O2
0,2-------------------------0,3 mol
n O2=\(\dfrac{6,72}{22,4}\)=0,3 mol
H=85%
=>m KClO3=0,2.122,5.\(\dfrac{100}{85}\)=28,82g
c)
2KClO3-to\xt->2KCl+3O2
0,2------------------------0,3
n KClO3=\(\dfrac{24,5}{122,5}\)=0,2 mol
H=80%
=>m O2=0,3.32.\(\dfrac{80}{100}\)=10,4g

nP= 6,2 : 31 = 0,2 (MOL)
nO2 = 6,4 : 32= 0,2 (mol)
pthh : 4P+5O2 -t--> 2P2O5
LTL
0,2/4 > 0,2/5
=> P du
2
nO2 = 2,24 : 22,4 =0,1 (mol)
pthh : KMnO4 -t-> K2MnO4 + MnO2 + O2
0,2 <-------------------------------0,1 (mol)
mKMnO4 = 0,2 . 158 = 31,6 (g)

a) \(n_{K_2O}=\dfrac{37,6}{94}=0,4\left(mol\right)\)
PTHH: K2O + H2O --> 2KOH
0,4------------>0,8
=> mKOH = 0,8.56 = 44,8 (g)
b) \(C_M=\dfrac{0,8}{0,5}=1,6M\)
c)
PTHH: 4K + O2 --to--> 2K2O
0,2<----0,4
=> VO2 = 0,2.22,4 = 4,48 (l)

\(pthh:2KMnO_4\overset{t^o}{--->}K_2MnO_4+MnO_2+O_2\uparrow\)
\(n_{O_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
Theo pt: \(n_{KMnO_4}=0,2\left(mol\right)\)
\(\Rightarrow m_{KMnO_4}=0,2.158=31,6\left(g\right)\)
Chọn D
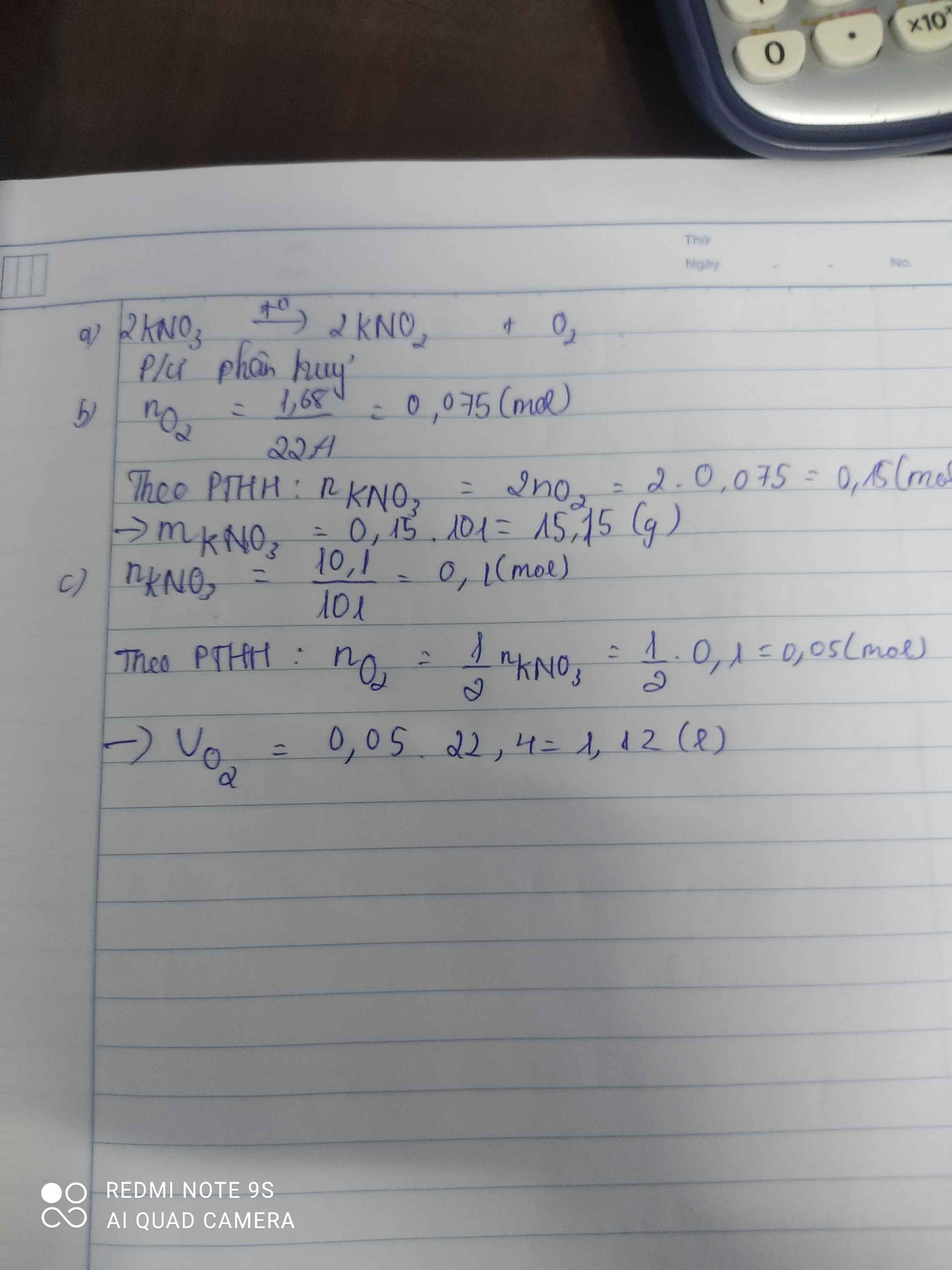
\(K+H_2O\to KOH+\dfrac{1}{2}H_2\\ n_{H_2}=\dfrac{2,24}{22,4}=0,1(mol)\\ \Rightarrow n_{K}=2n_{H_2}=0,2(mol)\\ \Rightarrow m_{K}=0,2.39=7,8(g)\)