Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a) Ta có: \(\dfrac{R}{R+16\cdot3}=\dfrac{40}{100}\) \(\Rightarrow R=32\) (Lưu huỳnh)
Vậy CTHH của oxit là SO3 (Lưu huỳnh trioxit)
b) PTHH: \(SO_3+H_2O\rightarrow H_2SO_4\)
Ta có: \(n_{H_2SO_4}=\dfrac{9,6}{80}=0,12\left(mol\right)=n_{H_2SO_4}\)
\(\Rightarrow C\%_{H_2SO_4}=\dfrac{0,12\cdot98}{9,6+90,4}\cdot100\%=11,76\%\)

Chị nghĩ đề là 2,24 sẽ hợp lý hơn nhé! Còn nếu em vẫn để số liệu là 2,688 thì hướng làm vẫn như vậy chỉ là số liệu khác nhưng mà chị tính hiện tại theo số liệu của em thì không ra.
Bài làm
\(\begin{array}{l}
{n_{C{O_2}}} = \dfrac{{2,24}}{{22,4}} = 0,1mol\\
C{O_2} + KOH \to KHC{O_3}\\
C{O_2} + 2KOH \to {K_2}C{O_3}\\
hh:KHC{O_3}(a\,mol),{K_2}C{O_3}(b\,mol)\\
\left\{ \begin{array}{l}
a + b = 0,1mol\\
100a + 138b = 11,4
\end{array} \right.\\
\Rightarrow a = 0,06;b = 0,04\\
{n_{KOH}} = {n_{KHC{O_3}}} + 2{n_{{K_2}C{O_3}}} = 0,14mol\\
{m_{KOH}} = 0,14 \times 56 = 7,84g\\
C{\% _{KOH}} = \dfrac{{7,84}}{{150}} \times 100\% = 5,227\% \\
C{\% _{KHC{O_3}}} = \dfrac{{0,06 \times 100}}{{0,1 \times 44 + 150}} \times 100\% = 3,88\% \\
C{\% _{{K_2}C{O_3}}} = \dfrac{{0,04 \times 138}}{{0,1 \times 44 + 150}} \times 100\% = 3,575\%
\end{array}\)

Câu 5. a) \(SO_2+\dfrac{1}{2}O_2-^{t^o,V_2O_5}\rightarrow SO_3\)
\(n_{SO_3}=n_{SO_2}=0,1\left(mol\right)\)
\(SO_3+H_2O\rightarrow H_2SO_4\)
\(n_{H_2SO_4}=n_{SO_3}=0,1\left(mol\right)\)
=> \(CM_{H_2SO_4}=\dfrac{0,1}{0,2}=0,5M\)
b) \(n_{Zn}=0,05\left(mol\right)\)
\(Zn+H_2SO_4\rightarrow ZnSO_4+H_2\)
Lập tỉ lệ : \(\dfrac{0,05}{1}< \dfrac{0,1}{1}\)=> Sau phản ứng H2SO4 dư
=> \(m_{H_2SO_4\left(dư\right)}=\left(0,1-0,05\right).98=4,9\left(g\right)\)
Câu 5 . \(n_{Al_2O_3}=0,2\left(mol\right);n_{H_2SO_4}=0,8\left(mol\right)\)
\(Al_2O_3+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2O\)
Lập tỉ lệ: \(\dfrac{0,2}{1}< \dfrac{0,8}{3}\) => Sau phản ứng H2SO4 dư
\(m_{H_2SO_4}=\left(0,8-0,2.3\right).98=19,6\left(g\right)\)
b)\(n_{Al_2\left(SO_4\right)_3}=n_{Al_2O_3}=0,2\left(mol\right)\)
\(m_{Al_2\left(SO_4\right)_3}=0,2.342=68,4\left(g\right)\)

\(n_{H_2SO_4}=\dfrac{200\cdot19.6\%}{98}=0.4\left(mol\right)\)
\(SO_3+H_2O\rightarrow H_2SO_4\)
\(0.4......................0.4\)
\(m_{SO_3}=0.4\cdot80=32\left(g\right)\)
\(b.\)
\(n_{H_2SO_4}=\dfrac{80\cdot19.6\%}{98}=0.16\left(mol\right)\)
\(MgO+H_2SO_4\rightarrow MgSO_4+H_2O\)
\(0.16..........0.16..............0.16\)
\(m_{MgO}=0.16\cdot40=6.4\left(g\right)\)
\(m_{\text{dung dịch sau phản ứng}}=6.4+80=86.4\left(g\right)\)
\(C\%MgSO_4=\dfrac{0.16\cdot120}{86.4}\cdot100\%=22.22\%\)
a)
$SO_3 + H_2O \to H_2SO_4$
n SO3 = n H2SO4 = 200.19,6%/98 = 0,4(mol)
=> m = 0,4.80 = 32(gam)
b)
$MgO + H_2SO_4 \to MgSO_4 + H_2O$
n MgSO4 = n MgO = n H2SO4 = 80.19,6%/98 = 0,16(mol)
=> m MgO = 0,16.40 = 6,4(gam)
Sau pư, m dd = 6,4 + 80 = 86,4(gam)
=> C% MgSO4 = 0,16.120/86,4 .100% = 22,22%

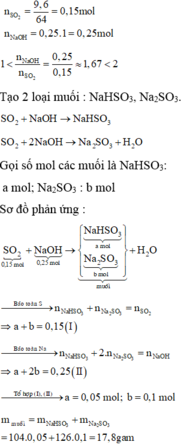
\(n_{SO_3}=\dfrac{9,6}{80}=0,12\left(mol\right)\) ; \(n_{H_2O}=\dfrac{90,4}{18}\approx5,02\left(mol\right)\)
PTHH : SO3 + H2O ---> H2SO4
Vì \(n_{H2O}>n_{SO3}\) => H2O dư
Theo PTHH : nH2SO4 = nSO3 = 0,12 (mol)
=> mH2SO4 = 0,12.98 = 11,76 (g)
Theo ĐLBTKL : mSO3 + mH2O = mH2SO4
=> mH2SO4 = 9,6 + 90,4 = 100 (g)
=> \(C\%_{ddH2SO4}=\dfrac{11,76}{100}.100\%=11,76\%\)