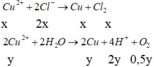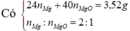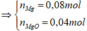Hòa tan hết 25,76 gam hỗn hợp gồm Fe3O4 và Cu vào dung dịch HCl loãng dư, thu được dung dịch X. Điện phân dung dịch X bằng điện cực trơ, có màng ngăn với cường độ dòng điện I = 5A, sau thời gian 2316 giây, khối lượng catot bắt đầu tăng. Nếu tiếp tục điện phân thêm 4632 giây, tổng thể tích khí thu được của cả quá trình điện phân là 4,48 lít (đktc); đồng thời thu được dung dịch Y. Cho dung dịch AgNO3 dư vào Y, thu được m gam kết tủa. Giá trị của m là
![]()
![]()
![]()
![]()