Điện phân dung dịch chứa m gam hỗn hợp CuSO4 và KC1 bằng điện cực trơ, màng ngăn xốp với cường độ dòng điện không đổi I = 5A. Sau thời gian t giây, thấy khối lượng dung dịch giảm 16,85 gam. Nhúng thanh Mg (dư) vào dung dịch sau điện phân, kết thúc phản ứng thấy thoát ra 3,584 lít khí H2 (đktc); cân lại thanh Mg thấy khối lượng giảm 1,44 gam. Giả sử kim loại sinh ra đều bám trên thanh Mg. Phát biểu nào sau đây đúng?
A. Giá trị của m là 33,91 gam
B. Nếu thời gian điện phân là 9264 giây, nước bắt đầu điện phân ở cả hai cực
C. Nếu thời gian điện phân là 10036 giây, khối lượng catot tăng 16,64 gam
D. Nếu thòi gian điện phân là 9843 giây, số mol khí thoát ra ở hai điện cực là 0,1475 mol



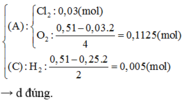
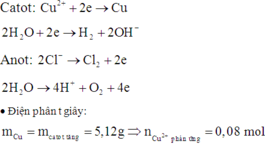
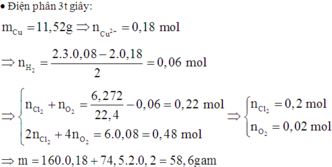


Chọn đáp án D
Vì nhúng Mg vào dung dịch sau điện phân có H2 sinh ra Þ Có H+
Nếu dung dịch sau điện phân không có Cu2+ thì mThanh Mg giảm = 0,16x24 = 3,84 gam
Þ Cu2+ chưa bị điện phân hết
nH2 = 0,16 Þ nO2 ở anot = 0,16/2 = 0,08
Đặt nCu bị điện phân là x => nCl2 = x - 0,08x2 = x - 0,16
Þ 16,85 = 64x + 71x(x - 0,16) + 32x0,08 => x = 0,19
Đặt nCu2+ còn dư là y Þ nCu bám vào thanh Mg = 64y Þ nMg phản ứng = y + 0,16
Þ 1,44 = 24x(y + 0,16) - 64y Þ y = 0,06
BTNT.Cl Þ nKCl ban đầu = (0,19 - 0,16)x2 = 0,06
BTNT.Cu Þ nCuSO4 = x + y = 0,25
Vậy m = 0,25x160 + 0,06x74,5 = 44,47 Þ Đáp án A sai
Nếu thời gian điện phân là 9264 giây ứng với ne = 9264x5/96500 = 0,48 < 0,25x2 Þ Lúc này Cu2+ cũng chưa điện phân hết Þ H2O chưa điện phân ở catot Þ Đáp án B sai
Nếu thời gian điện phân là 10036 giây ứng với ne = 9264x5/96500 = 0,52 > 0,25x2 Þ Cu2+ đã điện phân hết Þ mCatot tăng = 0,25x64 = 16 gam Þ Đáp án C sai
Nếu thời gian điện phân là 9843 giây ứng với ne = 9843x5/96500 = 0,51 > 0,25x2 Þ Cu2+ đã điện phân hết Þ nH2 = 0,51/2 - 0,25 = 0,005; nO2 = (0,51 - 0,06)/4 = 0,1125
Tổng nKhí= 0,005 + 0,06/2 + 0,1125 = 0,1475 Þ Đáp án D đúng.