Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Chọn C
Do khi ta điện phân tiếp mà khối lượng catot vẫn tiếp tục tăng chứng tỏ ở t (s) thì Cu2+ chưa điện phân hết
Tại t (s):
Catot: Cu2+ + 2e → Cu
0,16 ←0,08
Tiếp tục điện phân tiếp 2t (s) nghĩa là tại 3t (s):
Catot:
Cu2+ + 2e → Cu
0,36 ←0,18
2H2O + 2e → 2OH- + H2.
Anot: 2Cl- → Cl2 + 2e
2x x 2x
2H2O → 4H+ + O2 + 4e
2y→4y → y→ 4y
Tại t = 3t (s) thì số mol e trao đổi gấp 3 lần tại t(s)
→ n(e trong quá trình tạo H2) = 0,16. 3 – 0,36 = 0,12 → n(H2) = 0,06
BT e: 2x + 4y = 0,48
Tổng số mol khí: x + y + 0,06 = 0,28
→ x = 0,2 và y = 0,02 → m = 0,18. 160 + 0,4. 74,5 = 58,6 (g)

Chọn đáp án C.
Phương trình điện phân:
Catot: C u 2 + + 2 e → C u
![]()
![]()
· Điện phân t giây:
m C u = m c a t o t = 5 , 12 g
⇒ n C u 2 + p h ả n ứ n g = 0 , 08 m o l
· Điện phân 3t giây:
m C u = 11 , 52 g ⇒ n C u 2 + = 0 , 18 m o l
⇒ n H 2 = 2 . 3 . 0 , 08 - 2 . 0 , 18 2 = 0 , 06 m o l
⇒ n C l 2 + n O 2 = 6 , 272 22 , 4 - 0 , 06 = 0 , 22 m o l 2 n C l 2 + 4 n O 2 = 6 . 0 , 08 = 0 , 48 m o l
⇒ n C l 2 = 0 , 2 m o l n O 2 = 0 , 02 m o l
![]()

Đáp án A
Do khi ta điện phân tiếp mà khối lượng catot vẫn tiếp tục tăng chứng tỏ ở t (s) thì Cu2+chưa điện phân hết
Tại t (s):
Catot: Cu2+ + 2e → Cu
0,16 ←0,08
Tiếp tục điện phân tiếp 2t (s) nghĩa là tại 3t (s):
Catot:
Cu2+ + 2e → Cu Anot: 2Cl- → Cl2 + 2e
0,36 ←0,18 2x x 2x
2H2O + 2e → 2OH- + H2. 2H2O → 4H+ + O2 + 4e
2y→4y → y→ 4y
Tại t = 3t (s) thì số mol e trao đổi gấp 3 lần tại t(s)
→ n(e trong quá trình tạo H2) = 0,16. 3 – 0,36 = 0,12 → n(H2) = 0,06
BT e: 2x + 4y = 0,48
Tổng số mol khí: x + y + 0,06 = 0,28
→ x = 0,2 và y = 0,02 → m = 0,18. 160 + 0,4. 74,5 = 58,6 (g)

Đáp án C
Ở t giây ta thu được ở anot 0,12 mol hỗn hợp khí gồm Cl2 và O2.
Ở 2t giây ta thu được thể tích khí ở anot gấp 3 lần ở catot.
Goi số mol Cl2 và O2 ở t giây lần lượt là a, b
=> a+b=0,12
Bảo toàn e: n e = 2 a + 4 b
Lúc 2t giây: n e = 4 a + 8 b
Lúc này ở anot thu được Cl2 a mol và O2 → n O 2 = 4 a + 8 b - 2 a 4 = 0 , 5 a + 2 b
Do vậy ở catot thu được là H2 với số mol H2 = 0 , 5 a + 2 b + a 3 = 0 , 5 a + 2 b 3
Bảo toàn e:
n C u 2 + = 2 a + 4 ( 0 , 5 a + 2 b ) - 2 ( 0 , 5 a + 2 b 3 ) 2 = 1 , 5 a + 10 b 3 → 64 ( 1 , 5 a + 10 b 3 ) = 18 , 56
Giải hệ: a = b = 0,06 mol
Do vậy số mol KCl là 0,12 mol và CuSO4 là 0,29 mol.
m = 55,54 gam.

Chọn đáp án A.
Đặt số mol của CuSO4 và KCl lần lượt là x, y.
Phương trình điện phân:
Catot: Cu2+ +2e → Cu
2H2O + 2e → 2OH- + H2
Anot: 2Cl- → Cl2 + 2e
2H2O → 4H+ + 4e + O2
Điện phân t giây:
0 , 5 y + n O 2 t = 2 , 688 22 , 4 = 0 , 12 m o l
⇒ n O 2 t = 0 , 12 - 0 , 5 y
=> nđiện phân = y + 4 . 0 , 12 - 0 , 5 y = 0 , 48 - y
Điện phân 2t giây:
nđiện phân = 2 . 0 , 48 - y mol
⇒ n O 2 2 t = 0 , 24 - 0 , 75 y mol
mcatot tăng = 64 x = 18 , 56 ⇒ x = 0 , 29
⇒ n H 2 = 019 - y
⇒ m = 160 x + 74 , 5 y = 55 , 34 g

Chọn đáp án A
Xét t(s): Khối lượng catot tăng ⇒ ion M2+ bị điện phân. Khí duy nhất ở anot là Cl2.
2Cl– → Cl2 + 2e ⇒ ne = nNaCl = 2nCl2 = 0,4 mol ⇒ mMSO4 = 43,24 - 0,4 × 58,5 = 19,84(g).
Xét 2t(s): ne = 0,8 mol || 2H2O → 4H+ + O2 + 4e ⇒ nO2 = 0,1 mol.
⇒ manot giảm = 0,2 × 71 + 0,1 × 32 = 17,4(g) ⇒ mcatot giảm = 8,096(g).
Đặt nMSO4 = x ⇒ (M + 96).x = 19,84 (1) || 2H2O + 2e → 2OH– + H2
⇒ nH2 = (0,8 – 2x) ÷ 2 = 0,4 – x ⇒ 2 × (0,4 – x) + M.x = 8,096 (2)
(1) và (2) ⇒ M.x = 7,552 và x = 0,128 ⇒ M = 7,552 ÷ 0,128 = 59 (Ni).




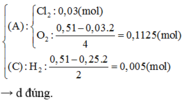

Đáp án C