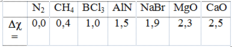
Dựa vào độ âm điện, hãy sắp xếp theo chiều tăng độ phân cực của liên kết giữa 2 nguyên tử trong phân tử các chất sau: CaO, MgO, CH4, AlN, N2, NaBr, BCl3(Cho độ âm điện của O = 3,5; Cl = 3,0; Br = 2,8; Na = 0,9; Mg = 1,2; Ca = 1,0; C = 2,5; H = 2,1; Al = 1,5; N = 3; B =2,0). A. N2, CH4, BCl3, AlN, NaBr, MgO, CaO B. N2, CH4, AlN, BCl3, NaBr, MgO, CaO C. N2, CH4, BCl3, AlN, NaBr, CaO, MgO D. N2, CH4, AlN, NaBr, BCl3, MgO,...
Đọc tiếp
Dựa vào độ âm điện, hãy sắp xếp theo chiều tăng độ phân cực của liên kết giữa 2 nguyên tử trong phân tử các chất sau: CaO, MgO, CH4, AlN, N2, NaBr, BCl3(Cho độ âm điện của O = 3,5; Cl = 3,0; Br = 2,8; Na = 0,9; Mg = 1,2; Ca = 1,0; C = 2,5; H = 2,1; Al = 1,5; N = 3; B =2,0).
A. N2, CH4, BCl3, AlN, NaBr, MgO, CaO
B. N2, CH4, AlN, BCl3, NaBr, MgO, CaO
C. N2, CH4, BCl3, AlN, NaBr, CaO, MgO
D. N2, CH4, AlN, NaBr, BCl3, MgO, CaO

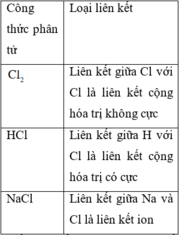
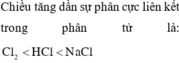
Chọn B
Dựa vào bảng 6: giá trị độ âm điện của nguyên tử một số nguyên tố nhóm A theo Pau – linh (SGK Hóa 10 – CB trang 45)
Tính được hiệu độ âm điện của các nguyên tố như sau:
→ Các chất được sắp xếp theo thứ tự chiều giảm dần độ phân cực của liên kết trong phân tử là: CaO, MgO, NaBr, AlCl3, CH4